
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容. 你认为该同学的错误步骤有
你认为该同学的错误步骤有| 1000ρω |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
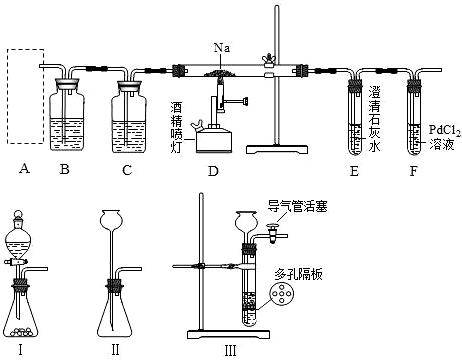
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
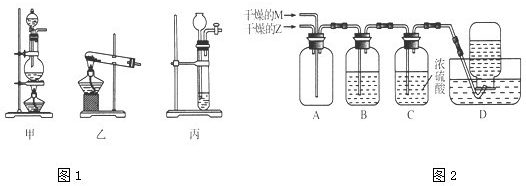
查看答案和解析>>
科目:高中化学 来源: 题型:
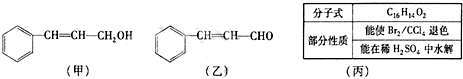
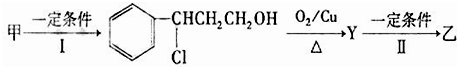
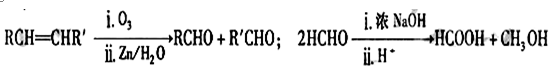
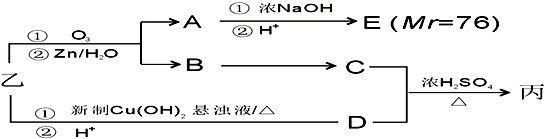
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该条件下此反应的化学平衡常数约为0.91 (L/mol)3 |
| B、A的平均反应速率为0.3mol/(L?s) |
| C、该反应在高温下可以自发进行 |
| D、若混合气体的压强不再改变时,该反应不一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
209 83 |
210 83 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com