
(1)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是________。
(2)化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO的原理如图所示。
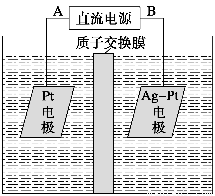
①电源正极为__________(填A或B),阴极反应式为________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
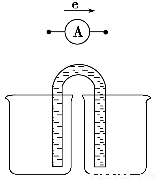
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是_________________________________________________________________。
④根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在所给的材料中应选__________作阳极。
(1)Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
(2)①A 2NO3-+6H2O+10e-=N2↑+12OH-
②14.4
(3)①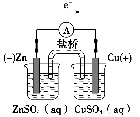 (或其他合理答案)
(或其他合理答案)
②失去金属光泽,被腐蚀或氧化,溶液蓝色变浅
③甲 在甲装置中,两个电极反应是在彼此隔离的条件下进行的,锌与Cu2+不直接发生反应,这样可以更彻底地将反应所释放的能量转化为电能 ④锌片
【解析】(1)该新型电池放电时,关键判断Al的氧化产物。由于NaOH溶液的存在,Al被氧化生成NaAlO2而不是Al(OH)3,故电池反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2。
(2)阴极:2NO3-+6H2O+10e-=N2↑+12OH-
阳极:10OH--10e-=5H2O+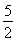 O2↑
O2↑
在阳极区生成的H+通过质子交换膜到达阴极区,所以,当电子过程中转移
10 mol e-时,
Δm左=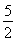 mol×32 g·mol-1+10 g=90 g
mol×32 g·mol-1+10 g=90 g
Δm右=28 g-10 g=18 g
所以当转移2 mol e-时,膜两侧电解液的质量变化差为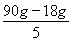 =14.4 g。
=14.4 g。
(3)①根据题给条件和原电池的构成条件可得:
a.若用Zn、Cu、CuSO4(aq)、ZnSO4(aq)组成原电池,Zn作负极,Cu作正极,Zn插入到ZnSO4(aq)中,Cu插入到CuSO4(aq)中。
b.若用Fe、Cu、FeSO4(aq)、CuSO4(aq)组成原电池,Fe作负极,Cu作正极,Fe插入到FeSO4(aq)中,Cu插入到CuSO4(aq)中。
c.注意,画图时要注意电极名称,电极材料,电解质溶液名称(或化学式),并形成闭合回路。②由于金属活动性Zn>Fe>Cu,锌片或铁片作负极,由于Zn或Fe直接与CuSO4溶液接触,工作一段时间后,负极本身被腐蚀或氧化,失去金属光泽,质量减轻,蓝色变浅。③带有盐桥的甲原电池中负极没有和CuSO4溶液直接接触,二者不会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;而原电池乙中的负极与CuSO4溶液直接接触,两者会发生置换反应,部分化学能转化为热能,化学能不可能全部转化为电能。④由牺牲阳极的阴极保护法可得,铁片作正极(阴极)时被保护,作负极(阳极)时被腐蚀,所以应选择比铁片更活泼的锌作负极(阳极)才能有效地保护铁不被腐蚀。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高二人教版化学选修五 1-2有机化合物的结构特点练习卷(解析版) 题型:选择题
一种有机物的化学式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的卤代烃的种类共有( )
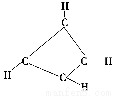
A.2 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2014年高中化学创新训练上专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:选择题
下列说法不正确的是 ( )。
A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解
B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
C.铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.HNO3→NO→NO2,以上各步变化均能通过一步实现
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列有关分类的观点正确的是( )。
①由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应
②铅蓄电池、锂电池、碱性锌锰电池都属于二次电池
③碳素钢、不锈钢和目前流通的硬币都属于合金
④生物质能、沼气和乙醇都是可再生能源
⑤氨水、醋酸、氢氧化铝都属于弱电解质
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上专题1物质组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列化学用语使用不正确的是( )。
A.Na+的结构示意图为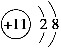
B.明矾的化学式为KAl(SO4)2·12H2O
C.聚乙烯的结构简式为CH2===CH2
D.高氯酸(HClO4)中氯元素的化合价为+7
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题8电化学原理练习卷(解析版) 题型:选择题
下列说法正确的是 ( )。
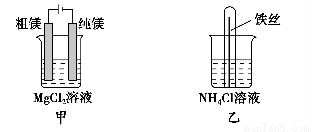
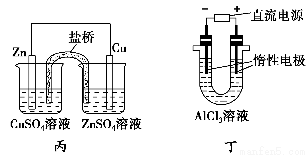
A.用甲装置电解精炼镁
B.用乙装置验证试管中铁丝发生析氢腐蚀
C.用丙装置构成铜锌原电池
D.用丁装置利用电冶金法制铝
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题7电解质溶液练习卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-??H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”、“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能________0.11 mol·L-1(填“<”、“>”或“=”),理由是_________________________________________________________________。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
A.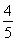 v(NH3)=v(O2)
v(NH3)=v(O2)
B.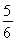 v(O2)=v(H2O)
v(O2)=v(H2O)
C.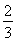 v(NH3)=v(H2O)
v(NH3)=v(H2O)
D.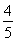 v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目:高中化学 来源:2014年高中化学二轮创新训练上 专题2常用化学计量-物质的量练习卷(解析版) 题型:选择题
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )。
A.3.2 g B.4.0 g C.4.2 g D.4.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com