
分析 (1)反应MnO2+4HCl═MnCl2+Cl2↑+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物;
(2)作还原剂的盐酸也就是被氧化的HCl生成氯气,根据氯原子守恒可知n还原剂(HCl)=2n(Cl2);根据方程式计算Cl2的物质的量,再根据V=nVm计算氯气的体积.
解答 解:(1)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,Cl2为氧化产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: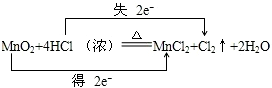 ,
,
故答案为: ;:
;:
(2)43.5g的MnO2的物质的量=$\frac{43.5g}{87g/mol}$=0.5mol,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
0.5mol 0.5mol
所以生成氯气为0.5mol,标况下其体积为0.5mol×22.4L/mol=11.2L,作还原剂的盐酸也就是被氧化的HCl生成氯气,根据氯原子守恒可知n还原剂(HCl)=2n(Cl2)=0.5mol×2=1mol,
答:作还原剂的盐酸的物质的量是1mol,生成氯气的体积为11.2L.
点评 本题考查根据方程式计算、氧化还原反应计算等,比较基础,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
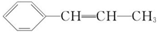
| A. | 该物质属于苯的同系物 | |
| B. | 1 mol 该物质一定条件下最多能与 1 mol H2 发生加成反应 | |
| C. | 所有碳原子可能在同一平面上 | |
| D. | 所有原子可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.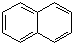 )的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氢.
)的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氢.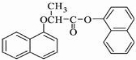 .
. ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能使溴水褪色 | B. | 能与过量的氢气充分反应生成丙醛 | ||
| C. | 不能发生银镜反应 | D. | 能被新制的氢氧化铜氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦⑩ | B. | ②③④⑩ | C. | ⑤⑥⑦⑧ | D. | ①②⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和盐酸反应:CO32-+2H-═H2O+CO↑ | |
| B. | 将Fe2O3溶于稀盐酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向稀盐酸溶液中加入铁粉:3Fe+6H-═3Fe3++3H2↑ | |
| D. | 把少量钠投人水中:Na+H2O═OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
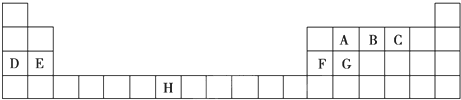
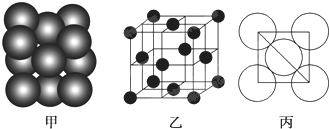
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com