
(10分)
I.在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,一定条件下发生反应:NO2+CO===CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,
①该段时间内,用CO2表示的平均反应速率为
②2 min时,容器内气体的总物质的量为 。
③假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量 (填“大于”、“小于”或“等于”)2 min时容器内气体的总物质的量。
II.将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
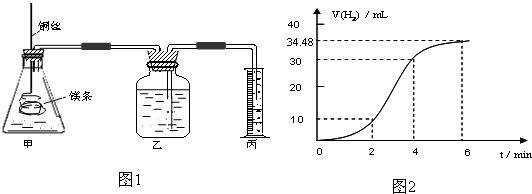
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)
I.在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,一定条件下发生反应:NO2+CO===CO2+NO,2 min时,测得容器中NO的物质的量为0.5mol ,
①该段时间内,用CO2表示的平均反应速率为
②2 min时,容器内气体的总物质的量为 。
③假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量 (填“大于”、“小于”或“等于”)2 min时容器内气体的总物质的量。
II.将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
I.在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,一定条件下发生反应:NO2+CO===CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,
①该段时间内,用CO2表示的平均反应速率为
②2 min时,容器内气体的总物质的量为 。
③假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量 (填“大于”、“小于”或“等于”)2 min时容器内气体的总物质的量。
II.将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com