
| m |
| M |
| 9g |
| 27g/mol |
| 1 |
| 3 |
| m |
| M |
| 10g |
| 100g/mol |
| m |
| M |
| 10g |
| 30g/mol |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量 铁粉 | ||
| ② | 加入少量Na2O2粉末 | ||
| ③ | 加入少量AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
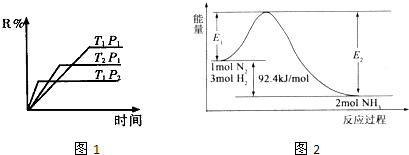
查看答案和解析>>
科目:高中化学 来源: 题型:
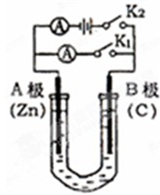 如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.
如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
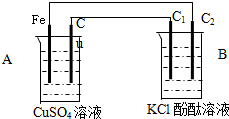 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑤④①③⑦⑥② |
| B、②⑥⑦③①⑤④ |
| C、④⑤①③⑦⑥② |
| D、②⑥⑦③①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L该溶液中含KNO3101g | ||
B、100mL该溶液中含N
| ||
| C、从1L该溶液中取出100mL,所取出的KNO3溶液的浓度为0.01mol/L | ||
| D、在1L水中溶解10.1g KNO3,即可配制得0.1mol/L KNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com