
| A. | CH4、CCl4、C60都是含有极性键的非极性分子 | |
| B. | 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 | |
| C. | 弱电解质水溶液导电能力不一定比强电解质水溶液导电能力弱 | |
| D. | 空间利用率:简单立方堆积<体心立方堆积<六方最密堆积<面心立方最密堆积 |
分析 A.不同种非金属原子间一般形成极性键,电性中心重合的分子为非极性分子;
B.元素的非金属性越强,对应的氢化物越稳定;
C.导电能力取决于溶液中自由移动离子的浓度和所带电荷数,与电解质的强弱无必然联系;
D.根据不同堆积模型的空间利用率判断.
解答 解:A.不同种非金属原子间一般形成极性键,电性中心重合的分子为非极性分子,C60中碳碳键为非极性键,故A错误;
B.因非金属性Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,则非金属氢化物的稳定性顺序:HCl>H2S>PH3,故B错误;
C.导电能力取决于溶液中自由移动离子的浓度和所带电荷数,与电解质的强弱无必然联系,故C正确;
D.空间利用率:体心立方堆积为68%,六方最密堆积为74%,面心立方最密堆积为74%,则空间利用率:体心立方堆积<六方最密堆积=面心立方最密堆积,故D错误.
故选C.
点评 本题综合考查了共价键的分类、分子的极性、元素周期律、导电性强弱比较和金属的堆积模型等知识,侧重于学生的分析能力和综合运用化学知识的能力,能较好地培养学生的科学素养,为高考常见题型,学习中注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=11的氨水中,由水电离产生的c (OH-)=10-11mol/L | |
| B. | pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液中,c (H+)>c (OH-) | |
| C. | NaHCO3溶液中,存在c (H+)=c (OH-)+c (CO32-) | |
| D. | 0.1mol/L的NH4Cl溶液中:c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA 族元素单质的熔点随着原子序数递增而升高 | |
| B. | 卤族元素单质的熔点随着原子序数递增而升高 | |
| C. | 第ⅤA族元素的气态氢化物沸点随着原子序数递增而升高 | |
| D. | 第三周期元素形成的简单离子半径随着原子序数递增而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
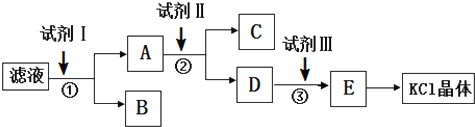
| A. | 起始滤液的pH=7 | |
| B. | 步骤②中加入试剂 II的目的是除去CO32- | |
| C. | 试剂 I为Ba(NO3)2溶液 | |
| D. | 试剂Ⅲ为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、M两种元素形成的化合物中只能存在离子键 | |
| B. | 元素Z的某种氧化物具有漂白性,是因为这种氧化物具有强氧化性 | |
| C. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| D. | 元素W和M的某些单质可作为水处理中的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ⑤⑥ | C. | ③⑥ | D. | ①⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
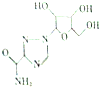 利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )| A. | 分子式为C8H12N4O3 | B. | 能使紫色石蕊试液变红 | ||
| C. | 可以发生酯化反应 | D. | 可以与H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com