
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
完成下列填空:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前
①用0.1mol·L-1H2SO4(aq)洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;
②将KNO3(aq)的pH调至2.5;
③为防止空气中的 (写化学式)对脱氮的影响,应向KNO3溶液中通入N2。
(2)用足量Fe粉还原上述KNO3(aq)过程中,反应物与生成物的离子浓度、pH随时间的变化关系如图所示。请根据图中信息写出t1时刻前该反应的离子方程式: 。

(3)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为 。如果反应中有5mol电子发生转移,可得到肼 g。
(4)常温下向25mL 0.01mol/L稀盐酸中缓缓通入5.6 mL NH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是 。在通入NH3的过程中溶液的导电能力 (填写“变大”、“变小”或“几乎不变”)。
(5)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是 (选填编号)。
a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡 (填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为 mol·L-1。
(1)去除铁粉表面的氧化物等杂质 (1分)、 O2(1分)
(2)4Fe+NO3—+10H+→4Fe2++NH4++3H2O(2分,物质正确写全1分,配平1分)
(3)2:1(1分)、80(1分)
(4)c(Cl-)>c(NH4+)>c(H+)>c(OH-)(1分)、几乎不变(1分)。
(5)ac(2分,每个1分)
(6)先正向移动,后逆向移动(1分)、0.4mol/L(1分)。
【解析】
试题分析:(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前①用H2SO4(aq)洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质如铁锈。③由于二价铁离子易被空气中的氧气氧化会对脱氮的影响,应向KNO3溶液中通入N2可以进行隔绝。
(2)由图中信息可以看出氢离子浓度减小,硝酸根浓度减小,二价铁离子浓度增大,铵根离子浓度增大,可以确定出反应物和生成物,并运用氧化还原反应原理得出t1时刻前该反应的离子方程式:4Fe+NO3—+10H+→4Fe2++NH4++3H2O。
(3)根据得失电子数相等,NH3----N2H4与NaClO---Cl-,该反应中被氧化(N)与被还原的元素的原子(Cl)个数之比为2:1。如果反应中有5mol电子发生转移时生成肼2.5mol,质量为80g。
(4)25mL 0.01mol/L稀盐酸物质的量是0.00025mol,5.6 mL NH3(标准状况)物质的量为0.00025mol,反应后恰好生成氯化铵,水解后呈酸性,其溶液中离子浓度由大到小的顺序是c(Cl-) >c(NH4+) >c(H+)> c(OH-) 。在通入NH3的过程中由于生成了一水合氨是弱电解质,产生的离子很小,溶液的导电能力几乎不变。
(5)向上述溶液中继续通入NH3,溶质为氯化铵和一水合氨,过程中溶液会呈中性,最终溶液呈碱性,所以该过程中离子浓度大小关系可能正确的是 a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) 呈中性;c.c(NH4+)>c(OH-)>c(Cl-)>c(H+)呈碱性;
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水时生成了铵根离子降低了溶液中的氢离子浓度此时平衡先正向移动,当盐酸反应完后溶液呈碱性时又对水的电离起到了抑制作用,使水的电离平衡逆向移动。当滴加氨水到25mL时,测得溶液中水的电离度最大说明恰好生成了氯化铵此时氨气的物质的量和氯化氢的物质的量相同都为0.01mol,则氨水的浓度为0.01/0.025=0.4mol/Lmol·L-1。
考点:本题考查了盐类水解,电离平衡及化学图像识别等知识。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源:2014届福建省高二上学期期末联考化学试卷(解析版) 题型:填空题
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
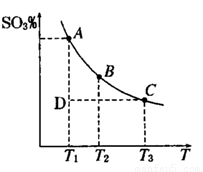
(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g) 2SO3(g),混合体系中SO3
的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
2SO3(g),混合体系中SO3
的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
①2SO2(g)+O2(g) 2SO3(g)的△H 0
2SO3(g)的△H 0
(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1
K2;反应进行到状态D时, 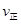
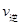 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农 业生产、生活中有着重要作用,
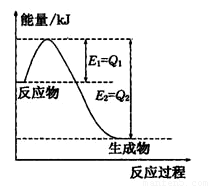
①如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:
(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水,在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数 .
(3)海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在,在25℃下,向0.1L0.002mol·L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16 )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com