
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| 200 |
| a |
| 200 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏锡常镇四市高三教学情况调研(二)化学试卷(解析版) 题型:实验题
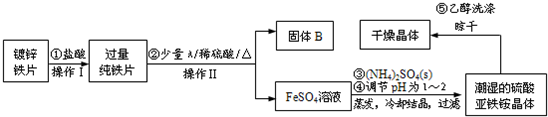
硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇。某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下:

(1)加入盐酸是为了除去锌镀层,判断锌镀层已被除去的现象是 。
(2)A物质可以是 (选填序号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是 。
(3)操作Ⅱ的名称为 。
(4)采用晾干而不用加热烘干晶体的原因是 。
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72—被还原成Cr3+。
写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省深圳市南山区高三上学期期末考试化学试卷(解析版) 题型:填空题
铬及其化合物在现代工业上的应用广泛,可用于电镀,鞣制羊毛,皮革;铬还用于照相材料,胶版印刷及化工触媒剂等。但化工废料铬渣对人体健康有很大危害。
Ⅰ:某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
|
阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
|
开始沉淀时的pH |
1.9 |
7.0 |
—— |
—— |
4.7 |
—— |
|
沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9 (>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施是 (至少答一点)。
(3)调节溶液的pH=8是为了除去 离子。钠离子交换树脂的原理为:
Mn++nNaR→MRn+nNa+,被交换的的杂质离子是 。
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH) 的溶度积Ksp= c(Cr3+)• c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
。
的溶度积Ksp= c(Cr3+)• c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
。
(5)还原过程发生以下反应(请配平): Na2Cr2O7+ SO2+
= Cr(OH) (H2O)5SO4+ Na2SO4;
Ⅱ:工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。
其中一种处理方法为电解法:该法用Fe做电极,电解含Cr2O72-的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe做电极的原因为
在阴极附近溶液pH升高的原因是(用电极反应解释) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com