(2008?海南)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg
3N
2).已知实验中可能会发生下列反应:
①2Mg+O
22MgO;②3Mg+N
2Mg
3N
2;③2Mg+CO
22MgO+C
④Mg+H
2O
MgO+H
2↑ ⑤Mg
3N
2+6H
2O
3Mg(OH)
2+2NH
3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).

回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别
B 目的是除气流中的水蒸汽,避免反应④发生;D 目的是除去空气中的CO2,避免反应③发生;F 目的是除去空气中的氧气,避免反应①发生
B 目的是除气流中的水蒸汽,避免反应④发生;D 目的是除去空气中的CO2,避免反应③发生;F 目的是除去空气中的氧气,避免反应①发生
;
(2)连接并检查实验装置的气密性.实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)
j→h→g→d→c→k→l(或l→k)→a→b (或b→a)
j→h→g→d→c→k→l(或l→k)→a→b (或b→a)
;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?
制得的氮化镁将不纯
制得的氮化镁将不纯
,原因是
因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应
因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应
;
(4)请设计一个实验,验证产物是氮化镁:
将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁
将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁
.

 (2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
(2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.

 考前必练系列答案
考前必练系列答案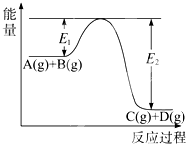 (2008?海南)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(2008?海南)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
