
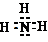 ;C气体的化学式是SO2.
;C气体的化学式是SO2.分析 某无机化合物A是一种正盐,A与氢氧化钠浓溶液反应,产生无色气体B,B气体可以使湿润的红色石蕊试纸变为蓝色,推断B为NH3,A与稀硫酸溶液反应,产生无色气体C,C气体可以使品红溶液褪色,推断C为SO2,则A为亚硫酸铵,
(1)B为NH3属于共价化合物,氮原子和氢原子形成三个共价键,C为二氧化硫;
(2)化合物A受热分解生成氨气、二氧化硫和水;
(3)B的水溶液为一水合氨溶液,二氧化硫是酸性氧化物,和一水合氨反应生成亚硫酸铵和水;
(4)Fe2O3系传感器可以检测B气体,反应时,铁的氧化物转化为低价态氧化物,同时有单质气体生成,氧化铁变化为氧化亚铁,氮元素化合价-3价变化为0价,依据氧化还原反应电子守恒和原子守恒配平书写化学方程式;
(5)B气体和氧气按一定比例混合,置于密闭容器中,里面连接铂丝,通过尖端间歇性放电,混合气体完全反应,只得到一种正盐D的水溶液,判断为NH4NO3的水溶液氨气催化氧化生成一氧化氮和水,一氧化氮和氧气和水反应生成硝酸,硝酸和氨气生成硝酸铵,据此书写化学方程式.
解答 解:某无机化合物A是一种正盐,A与氢氧化钠浓溶液反应,产生无色气体B,B气体可以使湿润的红色石蕊试纸变为蓝色,推断B为NH3,A与稀硫酸溶液反应,产生无色气体C,C气体可以使品红溶液褪色,推断C为SO2,则A为亚硫酸铵,
(1)B为NH3属于共价化合物,氮原子和氢原子形成三个共价键,电子式为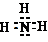
故答案为: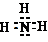
(2)化合物A受热分解生成氨气、二氧化硫和水,反应的化学方程式为(NH4)2SO3═NH3↑+SO2↑+H2O,
故答案为:(NH4)2SO3═NH3↑+SO2↑+H2O;
(3)B的水溶液为一水合氨溶液,二氧化硫是酸性氧化物,和一水合氨反应生成亚硫酸铵和水,反应的离子方程式为:SO2+2NH3•H2O═2NH4++SO32-+H2O,
故答案为:SO2+2NH3•H2O═2NH4++SO32-+H2O;
(4)Fe2O3系传感器可以检测B气体,反应时,铁的氧化物转化为低价态氧化物,同时有单质气体生成,氧化铁变化为氧化亚铁,氮元素化合价-3价变化为0价,依据氧化还原反应电子守恒和原子守恒配平书写化学方程式为:3Fe2O3+2NH3═6FeO+N2+3H2O,
故答案为:3Fe2O3+2NH3═6FeO+N2+3H2O;
(5)B气体和氧气按一定比例混合,置于密闭容器中,里面连接铂丝,通过尖端间歇性放电,混合气体完全反应,只得到一种正盐D的水溶液,判断为NH4NO3的水溶液,氨气催化氧化生成一氧化氮和水,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,一氧化氮和氧气和水反应生成硝酸,4NO+3O2+2H2O=4HNO3,反应的化学方程式为:2NH3+2O2=NH4NO3+H2O,B气体和氧气的体积比是1:1,
故答案为:NH4NO3;1:1.
点评 本题考查了无机物质转化的关系推断,主要是物质性质和反应产物的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 小苏打与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| B. | 向烧碱溶液中通入过量的CO2 CO2+2OH-═CO32-+H2O | |
| C. | 小粒钠投入冷水中 2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+4H++3NO3-═Ag++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 将AlCl3溶液蒸干灼烧 | 制备Al2O3 |
| B | 向淀粉水解后的溶液中,依次加入NaOH溶液、新制Cu(OH)2,共热 | 探究水解产物的还原性 |
| C | 向某溶液中加入稀硫酸,将产生的气体通入澄清石灰水 | 检验该溶液中是否含有CO32- |
| D | 向H2O2溶液中滴加少量FeCl3溶液 | 探究催化剂对化学反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中氯化钠的浓度为1 mol/L | |
| B. | 向所得的溶液中通入二氧化碳,可使溶液具备漂白性 | |
| C. | 所得溶液中有大量的单质的氯元素存在 | |
| D. | 在反应中氯元素化合价降低,钠元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,通过用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液和0.1 mol•L-1 CH3COONa溶液的pH来比较HClO和CH3COOH的酸性强弱 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用高锰酸钾溶液滴定Na2SO3溶液至终点:滴入最后一滴高锰酸钾溶液,溶液恰好由紫色变为无色,半分钟不变色 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ).
).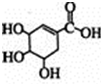 +Br2→
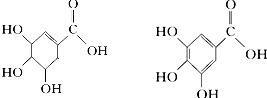
+Br2→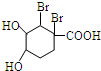 .
.
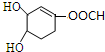 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸能与水以任意比互溶 | |
| B. | 1 mol•L-1甲酸溶液的pH约为2 | |
| C. | 10 mL 1 mol•L-1甲酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 甲酸溶液的导电性比盐酸溶液的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com