
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应: 3A(g) + B(g)  2C(g) + xD(g) ,若平衡时生成了2 mol C,D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g) + xD(g) ,若平衡时生成了2 mol C,D的浓度为0.5 mol·L-1,下列判断正确的是( )
A.X=2
B.平衡时混合气体密度增大
C.平衡时B的浓度为1.5 mol·L-1
D.当A与B的正反应速率为3:1时该反应达到平衡
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
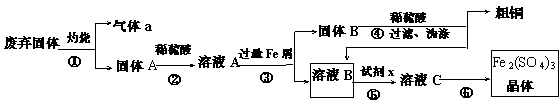

(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为 ,①和⑥中都用到的仪器为 ;
(2)试剂x的化学式为 ;x与溶液B反应的离子方程式为 ;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN- 被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1 硫酸、1.0 mol·L-1 NaOH溶液、
0.1 mol·L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证乙同学的猜测是否合理。简要说明实验步骤和现象
查看答案和解析>>
科目:高中化学 来源: 题型:
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。下列说法正确的是
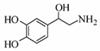 A. 去甲肾上腺素分子式为C8H10O3N
A. 去甲肾上腺素分子式为C8H10O3N
B. 每个去甲肾上腺素分子中含有3个酚羟基
C.1mol去甲肾上腺素最多能与2molBr2发生取代反应
D.去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,NaCl溶液中c(H+)=10-6 mol·L-1。该温度下,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A.9.0 B.9.5 C.8.5 D.10.5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能证明HNO2是弱电解质的是( )
A. 用HNO2溶液做导电性试验灯光较暗
B. HNO2是共价化合物
C.常温下,0.1 mol/L HNO2溶液的pH为2.2
D. HNO2溶液不与NaCl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是 ( )
A.溶液中的c(CH3COO-) B.溶液中的c(H+)
C.醋酸的电离平衡常数 D.溶液中的c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以氨气为原料制备硝酸的过程如图1所示:
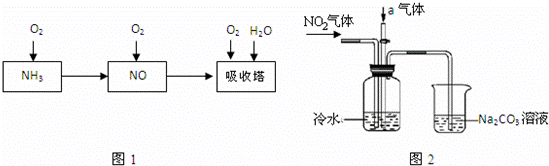
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是 ;
(2)连接好装置后,首先进行的操作是 ;
(3)通入a气体的目的是 ;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是 。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是 ;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)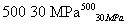 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的 检验,才能决定其正确与否,下列几种类推结论中,错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
④密度为1.1 g·cm-3与密度为1.2 g·cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g·cm-3与1.2 g·cm-3之间,Na-K合金的熔点应介于Na和K熔点之间
A.①② B.①④ C.①②③④ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com