
| A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△S<0 |
| B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和V(NH3)均增大 |
| D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题

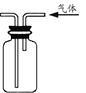
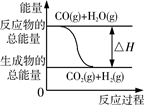
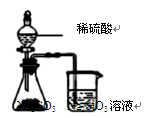
| A.图①两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
| B.用图②所示实验装置排空气法收集CO2气体 |
C.图③表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的△H大于0 CO2(g)+H2(g)的△H大于0 |
| D.用图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO(g);
2CO(g); 2CO2(g)
2CO2(g)| A.12gC所具有的能量一定高于28gCO所具有的能量 |
| B.56gCO和32gO2所具有的总能量一定高于88gCO2所具有的总能量 |
| C.12gC和32gO2所具有的总能量一定高于44gCO2所具有的总能量 |
| D.将相同质量的碳燃烧,生成CO2比生成CO放出的热量多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝和盐酸反应 | B.灼热的木炭与CO2反应 |
| C.氢气还原氧化铜 | D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.450kJ | B.650kJ | C.800kJ | D.520kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(固)+O2(气)=CO2(气); △H ="+393.5" kJ/mol |
B.C(固)+ O2(气)=CO(气); △H ="-393.5" kJ/mol O2(气)=CO(气); △H ="-393.5" kJ/mol |
| C.C + O2= CO2;△H ="-393.5" kJ/mol |
| D.C(固)+O2(气)=CO2(气); △H ="-393.5" kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com