
| ̼ | �� | Y | |
| X | �� | Z |
 ��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪMg2C3+4H2O=2Mg��OH��2+C3H4����
��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪMg2C3+4H2O=2Mg��OH��2+C3H4�������� ��Ԫ�������ڱ��е�λ�ÿ�֪XΪSi��YΪO��ZΪCl��
��1�����ڱ���ZԪ��Ϊ��Ԫ�أ��˵����Ϊ17���������Ӳ㣬�����7�����ӣ�
��2��ͬ����ԭ�Ӱ뾶���μ�С��ͬ����ԭ�Ӱ뾶��������
��3���ȽϷǽ���Ԫ�صķǽ�����ǿ�����ɸ��ݵ���֮����û���Ӧ����Ӧ����������ˮ��������ԡ��⻯����ȶ��ԵȽǶ��жϣ������ʧ������û�б�Ȼ��ϵ��
��4������������̼��������Ϊ9��1����N��C����N��H��=$\frac{9}{12}$��$\frac{1}{1}$=3��4��ӦΪC3H4��QΪMg2C3��
��5��X��Z��Ԫ�صĵ��ʷ�Ӧ����1molX����ۻ�����ָ������£�����687kJ����֪�û�������ۡ��е�ֱ�Ϊ-69���58�棬˵��������ΪҺ�壻
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���������ж�����ΪNO��NO2������ת��ΪNaNO3�����NO��NO2�����ʵ���������ԭ���غ㡢�����غ���ʽ������Ե����ʵ��������ݵ����غ�ɼ�����������ͭ�����ʵ�����
��� �⣺��Ԫ�������ڱ��е�λ�ÿ�֪XΪSi��YΪO��ZΪCl��
��1�����ڱ���ZԪ��Ϊ��Ԫ�أ��˵����Ϊ17���������Ӳ㣬�����7�����ӣ�λ�����ڱ��е������ڣ��ڢ���A�壬
�ʴ�Ϊ���������ڣ��ڢ���A�壻
��2������Ԫ��Ϊ�ڶ����ں��������е�Ԫ�أ�����ͬ����ԭ�Ӱ뾶���μ�С��ͬ����ԭ�Ӱ뾶�������������֪��Ԫ�ص�ԭ�Ӱ뾶������Si��
�ʴ�Ϊ��Si��
��3��a��Y������H2S��Һ��Ӧ����Һ����ǣ�˵�������������Ա���ǿ����˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ����a��ȷ��
b����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ࣬������ǿ�����ʧ������û�б�Ȼ��ϵ����b����
c��Ԫ�صķǽ�����Խǿ���⻯����ȶ���Խǿ��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸߣ�˵��Y�ķǽ����Խ�ǿ����c��ȷ��
�ʴ�Ϊ��ac��
��4������������̼��������Ϊ9��1����N��C����N��H��=$\frac{9}{12}$��$\frac{1}{1}$=3��4��ӦΪC3H4������ʽΪ ��QΪMg2C3����ˮ��Ӧ�ķ���ʽΪ Mg2C3+4H2O=2Mg��OH��2+C3H4����
��QΪMg2C3����ˮ��Ӧ�ķ���ʽΪ Mg2C3+4H2O=2Mg��OH��2+C3H4����
�ʴ�Ϊ�� �� Mg2C3+4H2O=2Mg��OH��2+C3H4����
�� Mg2C3+4H2O=2Mg��OH��2+C3H4����
��5��X��Z��Ԫ�صĵ��ʷ�Ӧ����1molX����ۻ�����ָ������£�����687kJ����֪�û�������ۡ��е�ֱ�Ϊ-69���58�棬˵��������ΪҺ�壬����SiCl4��
��Ӧ���Ȼ�ѧ����ʽΪSi��s��+2Cl2��g��=SiCl4��l����H=-687kJ/mol���ʴ�Ϊ��Si��s��+2Cl2��g��=SiCl4��l����H=-687kJ/mol��
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���������ж�����ΪNO��NO2������ת��ΪNaNO3��1mol�������뷴Ӧת�Ƶ��ӵ����ʵ���Ϊ4mol�����NO��NO2�����ʵ����ֱ�Ϊxmol��ymol����$\left\{\begin{array}{l}{x+y=2.2}\\{x+3y=4}\end{array}\right.$
��ã�x=1.3��y=0.9��
���ݵ����غ㣺n��CuSO4��=$\frac{4mol}{2}$=2mol��
�ʴ�Ϊ��NO 0.9mol��NO2 1.3mol��2mol��
���� ���⿼����ԭ�ӽṹ��Ԫ�������ɡ�Ԫ�����ڱ��Ĺ�ϵ��������ԭ��Ӧ�ļ����֪ʶ����Ŀ�Ѷ��еȣ���ȷԪ�����ڱ��ṹ��Ԫ������������Ϊ�ṹ����ע�������غ�˼���ڻ�ѧ�����е�Ӧ�ã�����������ѧ���ķ�����������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X�������Է���������Y�������Է��������� | |
| B�� | X������C2H4��Y������CH4 | |
| C�� | X������ܶ�С��Y������ܶ� | |
| D�� | ������A����������B���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ������� | B�� | �����������Ҵ� | C�� | ������������ | D�� | ���Ȼ�̼���屽 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʵ�����CaCl2��CaO2���е������� | |
| B�� | ���µ�ѹ�£���������ȵ�CO��N2��C2H2�������庬�е�ԭ���� | |
| C�� | ͬ�¡�ͬѹ��ͬ�����CO��NO���е������� | |
| D�� | ���ʵ�����ͬ���������ֱ�������������ȫ��Ӧʱת�Ƶĵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | pH=a�İ�ˮ��Һ��ϡ��10������pH=b����a=b+1 | |
| B�� | ����AgCl��Agl���������Һ��c��Ag+����c��Cl-������I-�� | |
| C�� | 25��ʱ��NH4Cl��Һ��KN����100��ʱNaCl��Һ��KN | |
| D�� | 1g����ȼ������Һ̬ˮ���ų�������Ϊ142.9kJ��������ȼ���ȵ��Ȼ�ѧ����ʽ���Ա�ʾΪ��H2��g��+$\frac{1}{2}$O2��g��=H2O��I����H=-285.8kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu+S$\frac{\underline{\;\;��\;\;}}{\;}$CuS | B�� | 3Cu+8HO3��Ũ��=3Cu��NO3��2+2NO��+4H2O | ||
| C�� |  | D�� | 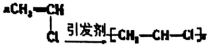 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Na+��=c��CH3COO-��+c��CH3COOH�� | B�� | c��H+��=c��CH3COO-��+c��OH-�� | ||
| C�� | c��Na+����c��CH3COO-����c��OH-����c��H+�� | D�� | c��CH3COO-����c��Na+����c��H+����c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �������ʵ�����HNO3��Na2CO3��CH3COOH����Һ | |
| B�� | pH=1��������pH=13�İ�ˮ�������� | |
| C�� | 0.05mol/L��H2SO4��0.1mol/L��KOH�������� | |
| D�� | pH=2��CH3COOH��pH=12��NaOH�������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com