
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
CO(g)+3H2(g) ΔH1=+206.1 kJ/mol
② CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
2CO(g)+2H2(g) ΔH2=+247.3 kJ/mol
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
⑴ 在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内, v(H2)= ▲ ;10 min时,改变的外界条件可能是 ▲ 。
![]()

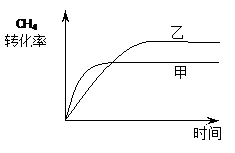
⑵ 如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。

⑶ 反应③中ΔH3= ▲ 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是 ▲ (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(1)0.3 mol/(L·min) 升高温度
(2)
(3)-41.2 kJ/mol a
本题以从甲烷得到合成气的3个反应为载体,考查学生对化学反应速率、化学平衡常数、化学平衡的移动、盖斯定律计算反应热等基本理论知识的掌握情况,以及应用相关知识解决实际问题的能力,具有一定的综合性。
 ⑴应根据图像先计算CH4的平均反应速率,再计算H2的生成速率。10 min时,改变的条件不可能是增大容器体积,否则改变条件的瞬间CH4浓度应减小。改变的条件可能是升高温度(或充入水蒸气)。
⑴应根据图像先计算CH4的平均反应速率,再计算H2的生成速率。10 min时,改变的条件不可能是增大容器体积,否则改变条件的瞬间CH4浓度应减小。改变的条件可能是升高温度(或充入水蒸气)。
(2)甲容器反应开始后压强增大,乙容器压强不变、体积增大,可看成是由甲容器减压得到,乙容器的反应速率慢、CH4转化率大。
(3)将反应①减去反应②即可得到反应③的反应热,根据浓度商小于平衡常数可以判断反应向正反应方向进行。v(正)>v(逆)


科目:高中化学 来源: 题型:



| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com