
 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.分析 (1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;根据中和热的实验的关键是保温;
(2)为了保证酸或碱中的一方完全反应,往往保证另一方过量;
(3)根据弱电解质电离吸热;
(4)a.实验装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:环形玻璃搅拌棒;保温、隔热防止热量散失;
(2)为了确保盐酸被完全中和,所用氢氧化钠溶液稍过量,故答案为:保证盐酸能够完全被中和;
(3)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小;
(4)a、实验装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.用量筒量取盐酸时俯视读数,会导致所量的盐酸体积偏小,放出的热量偏低,中和热的数值偏小,故b正确;
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,盐酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故选:abcd.
点评 本题考查中和热测定原理及误差分析,题目难度大,注意理解测定中和热的原理是解题的关键.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | N2O | C. | CH4 | D. | N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCO2所含的原子数为1.5NA | |
| B. | 常温常压下,48gO2与O3混合物含有的氧原子数为3NA | |
| C. | 标准状况下,22.4LCCl4中所含分子数为NA | |
| D. | 标准状况下,18g水所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
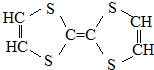
| A. | 它属于烃的衍生物 | B. | 所有的碳杂化方式相同 | ||
| C. | 属于高分子化合物 | D. | 它可以与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①④⑥ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com