
1.能证明乙炔分子中含有C≡C叁键的事实是( )
A.乙炔能使溴水褪色
B.乙炔能使酸性高锰酸钾溶液褪色
C.乙炔可以跟HCl气体加成
D.1mol乙炔可以和2mol H2发生加成反应
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温下,pH=2的H2SO4溶液中含有的H+数目为0.01NA
B.当H2O与Na2O2反应生成1 mol O2时,转移的电子数目为4NA
C.标准状况下,2.24 L CO和CO2的混合气体中含有的碳原子数为0.1NA
D.1 L 0.1 mol·L-1 FeCl3溶液中含有的Fe3+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
中华人民共和国国家标准(CB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图(a)装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。

(a)

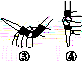
(b)
(1)仪器A的名称是__________________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中的H2O2完全反应,其化学方程式为________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图(b)中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________ g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选 项 | ① | ② | ③ | 实验结论 |
|
| A. | 稀 硫 酸 | Na2S | AgNO3与 AgCl的 浊液 | Ksp(AgCl)> Ksp(Ag2S) | |
| B. | 浓 硫 酸 | 蔗糖 | 溴水 | 浓硫酸具有脱 水性、氧化性 | |
| C. | 稀 盐 酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性 钡盐均可生成 白色沉淀 | |
| D. | 浓 硝 酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸> 碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图G41所示)。下列有关说法不正确的是( )
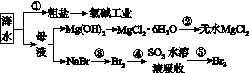
图G41
A.从能量转换的角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl的氛围中加热脱水制得无水MgCl2
C.在过程③、⑤中溴元素均被氧化
D.除去粗盐中的SO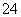 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
在室温和大气压强下,用下图所示的装置进行实验,测得a g含CaC290%的样品与水完全反应产生的气体体积为b L。现欲在相同条件下。测得某电石试样中CaC2的质量分数,请回答下列问题:
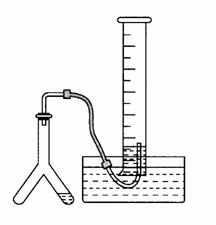
(1)CaC2和水反应的化学方程式是_______________________。
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是_________________________________________。
(3)本实验中测量气体体积时应注意的事项有________________。
(4)如果电石试样质量为c g,测得气体体积为d L,则试样中CaC2的质量分数的计算式:w(CaC2)=(杂质所生成的气体体积忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:
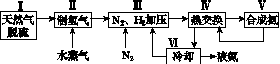
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
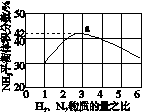

(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
处于平衡状态的反应2H2S(g) 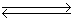 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下合理的说法是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下合理的说法是( )
A.加入催化剂,反应路径将发生改变,ΔH也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com