
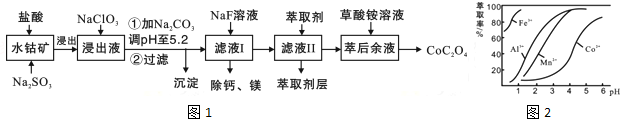
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则进入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴.
(1)Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+;
(2)氯气通入到热的浓氢氧化钠溶液得到NaClO3,还生成氯化钠与水;根据反应方程式计算需要氯气的物质的量,电解生成氢气与氯气的物质的量相等,进而计算氢气体积;
(3)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重;
(4)根据溶度积可知c(Mg2+):c(Ca2+)=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$;
(5)①NH3•H2O的电离平衡常数K=1.8×10-5mol•L,H2SO3的电离平衡常数K2=1.3×10-8mol•L-1,则SO32-的水解程度大于NH4+的水解程度,溶液呈碱性,溶液中氢氧根离子源于水的电离、SO32-的水解,溶液中c(OH-)>c(HSO3-);
②由电离平衡常数,可知NH4++OH-?NH3.H2O的平衡常数小于HSO3-+OH-?SO32-+H2O平衡常数,故加入少量NaOH溶液先与HSO3-反应.
解答 解:含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则进入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴.
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,
故答案为:将Co3+、Fe3+还原;
(2)氯气通入到热的浓氢氧化钠溶液得到NaClO3,还生成氯化钠与水,反应离子方程式为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O,10.65克NaClO3的物质的量为$\frac{10.65g}{106.5g/mol}$=0.1mol,由方程式可知需要氯气物质的量为0.1mol×3=0.3mol,根据电子转移守恒可知,电解生成氢气与氯气的物质的量相等,故氢气体积为0.3mol×22.4L/mol=6.72L,
故答案为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O;6.72;
(3)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3时最佳,
故答案为:除去Mn2+;B;
(4)根据溶度积可知c(Mg2+):c(Ca2+)=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7
故答案为:0.7;
(5)①NH3•H2O的电离平衡常数K=1.8×10-5mol•L,H2SO3的电离平衡常数K2=1.3×10-8mol•L-1,则SO32-的水解程度大于NH4+的水解程度,溶液呈碱性,溶液中氢氧根离子源于水的电离、SO32-的水解,溶液中c(OH-)>c(HSO3-),故溶液中离子浓度大小为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
②由电离平衡常数,可知NH4++OH-?NH3.H2O的平衡常数小于HSO3-+OH-?SO32-+H2O平衡常数,故加入少量NaOH溶液先与HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O,
故答案为:HSO3-+OH-=SO32-+H2O.
点评 本题考查物质制备工艺流程、物质的分离提纯、电离平衡常数应用等,侧重考查学生分析能力、获取信息能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 室温下,pH=3的氢氟酸加水稀释后,溶液pH减小 | |
| C. | 室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
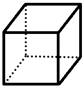 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.10mol H2O含有含有原子数为0.3NA | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 0.10mol•L-1Na2CO3溶液中含有Na+0.2NA | |
| D. | 14g CO和N2的混合气体中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质铁与水蒸气的反应 | B. | 铝片与氢氧化钠溶液的反应 | ||
| C. | 过氧化钠与二氧化碳的反应 | D. | 碳酸钠溶液与稀盐酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
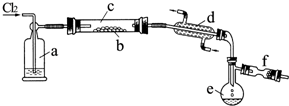 氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).
氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com