
【题目】在某强酸性无色溶液中,可能大量存在的离子是( )
A. SiO32- B. HCO3- C. Fe3+ D. Cl-
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】将标准状况下体积为2.24L的H2S缓慢通入100ml,1.5mol/L NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系不正确的是( )
A. c(Na+)+c(H+)=c(HS-)+2 c(S2-)+c(OH-) B. 2c(Na+)=3[c(HS-)+c(S2-)+c(H2S)]
C. c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) D. c(HS-)+c(S2-)+c(H2S)=1.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O═HCOO﹣+H3O+
B.CO2+H2O═HCO3﹣+H+
C.CO32﹣+H2O═HCO3﹣+OH﹣
D.HS﹣═S2﹣+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,也不是还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑
B.C12+H2O=HC1+HC1O
C.2F2+2H2O=4HF+O2
D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】车用妄全气囊中反应方程式为BNaN3=2Na+3N2↑,用双桥线标出电子 转移的数目和变化类型,指出氧化剂和还原剂.若要得到标准状况下33.6LN2 , 需要多少克NaN3(写出计算过程),NaN3的密度约为2g/cm3 , 则NaN3的体积约为多少立方厘米.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4 是一种重要的化工原料,其有关制备途径及性质如图所示。
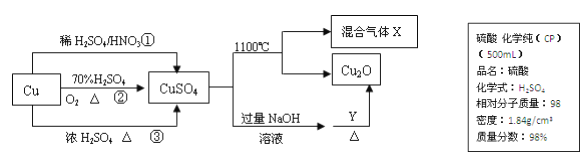
(1)现要用如上图所示的浓硫酸来配制步骤①中所需要的 1mol/L 的稀硫酸 480mL,需用这种浓硫酸的体积为________mL。(保留到小数点后 1 位)
(2)配制该稀硫酸溶液所用到的玻璃仪器除了玻璃棒、量筒、烧杯之外还有_____、_______。
(3)下列哪些操作会使所配的稀硫酸浓度减小________。
A.洗涤烧杯和玻璃棒的溶液未转入容量瓶
B.定容时,眼睛仰视溶液凹液面最低点
C. 容量瓶中原残留少量蒸馏水
D.定容摇匀后容量瓶液面低于刻度线,又加水定容到刻度线
E.量取浓硫酸时量筒内有少量蒸馏水
(4)制取硫酸铜的途径①、②、 ③中,途径______能更好地体现绿色化学思想。
(5)请写出途径③的化学反应方程式________________。
(6)配制 1000mL 0.1mol/L 的硫酸铜溶液,需用托盘天平称取_______g 胆矾。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L.当反应达到平衡时,可能存在的数据是( )
2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L.当反应达到平衡时,可能存在的数据是( )
A.SO2为0.8mol/L,O2为0.4 mol/L
B.SO2为0.5 mol/L
C.SO3为0.8 mol/L
D.SO2、SO3均为0.3 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com