
【题目】(1)实验室在配制Cu(NO3)2的溶液时,常将Cu(NO3)2固体先溶于较浓的硝酸中,再用蒸馏水稀释到所需的浓度,其目的是____;
(2)FeCl3可用作净水剂,其原理是(用离子方程式表示)____;将Al2(SO4)3溶液蒸干,最后得到的主要固体物质是____(写化学式)。
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)____c(H2C2O4)(填“大于”或“小于”或“等于”)。
(4)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是____(请用反应的离子方程式表示)。
【答案】抑制Cu2+的水解 Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ Al2(SO4)3 大于 3ClO-+Al3++3H2O=3HClO+Al(OH)3↓
Fe(OH)3(胶体)+3H+ Al2(SO4)3 大于 3ClO-+Al3++3H2O=3HClO+Al(OH)3↓
【解析】
(1)Cu(NO3)2溶液中铜离子容易水解,在配制时,常将Cu(NO3)2固体先溶于较浓的硝酸中抑制Cu2+的水解;
故答案为 : 抑制Cu2+的水解;
(2)FeCl3可用作净水剂是因为Fe3+在水中易水解产生Fe(OH)3(胶体),Fe(OH)3(胶体)具有吸附作用;Al2(SO4)3溶液蒸干过程中因为Al3+水解后形成的Al(OH)3与H2SO4,而硫酸是难挥发性酸,加热时其浓度增大,又会与氢氧化铝反应生成Al2(SO4)3;
故答案为 Fe3++3H2O![]() Fe(OH)3(胶体)+3H+; Al2(SO4)3;
Fe(OH)3(胶体)+3H+; Al2(SO4)3;
(3)因为草酸氢钾为酸性,即证明草酸氢根离子的电离程度大于水解程度,所以电离的草酸氢根离子比水解的草酸氢根离子多,故c(C2O42-)>c(H2C2O4);
故答案为 >;
(4)NaClO和KAl(SO4)2溶液混合后,ClO-与Al3+会双水解生成氢氧化铝胶体,反应的离子方程式为3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;
故答案为:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有化合物:
甲: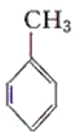 乙:
乙: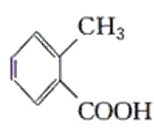 丙:
丙: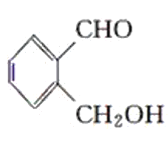
(1)请判别上述哪些化合物互为同分异构体(填序号):____________。
(2)请用一种试剂鉴别甲、乙、丙化合物。在下表中填入所选试剂及主要现象即可。________
试剂 | 现象 | |
甲 | ||
乙 | ||
丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 I( )是治疗心脏病的一种重要药物,可由简单有机物 A、B 和萘(
)是治疗心脏病的一种重要药物,可由简单有机物 A、B 和萘(  )合成,路线如下:
)合成,路线如下:

(1)C的结构简式为_________,E的化学名称_______。
(2)由萘生成C、B生成E的反应类型分别为_________、_________ 。
(3)I中含氧官能团的名称为_______。
(4)D可使溴水褪色,由D生成G的反应实现了原子利用率100%,则该反应的化学方程式为_______________。
(5)同位素标记可用来分析有机反应中的断键情况,若用超重氢(T)标记的
G( )与F反应,所得H的结构简式为
)与F反应,所得H的结构简式为  则反应中G(
则反应中G( )断裂的化学键为 _______(填编号)
)断裂的化学键为 _______(填编号)
(6)Y为H的同分异构体,满足以下条件的共有______种,请写出其中任意一种的结构简式_________。
①含有萘环,且环上只有一个取代基。
②可发生水解反应,但不能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 溶液中②、③点水的电离程度:③>②
C. 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D. 该滴定过程应该选择甲基橙作为指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________。
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(![]() )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率![]() =________%。
=________%。
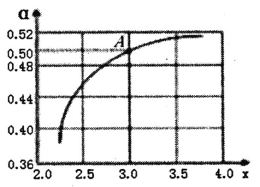
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______(kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
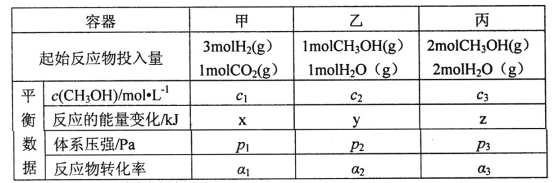
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________。
②下列说法正确的是________(填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
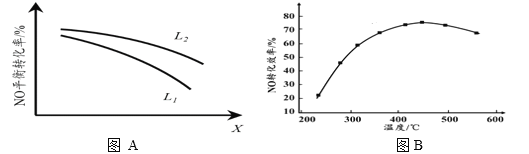
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,它们都含有少量Fe2O3、SiO2等杂质。工业上综合利用这两种矿物制备硫酸铜、硫酸锰和硫单质的主要工艺流程如下:
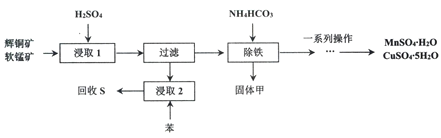
(1)浸取2过程中温度控制在500C~600C之间的原因是__________________。
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①_____________________________(用离子方程式表示)
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为_________________
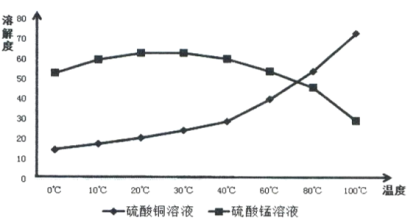
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),_____________
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g) ![]() xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
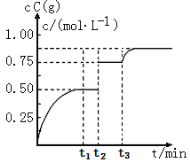
A. t2 时刻改变的条件是使用催化剂
B. t3时刻v(逆)可能小于t2 时刻v(逆)
C. t3时刻改变的条件一定是增大反应物的浓度
D. t1~t2、t2~t3平衡常数均为0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
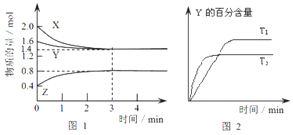
(1)容器中发生的反应可表示为_________________________;
(2)反应进行的前3min内,用X表示的反应速率v(X)=_____________;
(3)保持其他条件不变,升高温度,该反应的化学平衡将________方向移动;(填“正反应”或“逆反应”)
(4)①若X为有色气体,T℃ 时反应达平衡后,将反应容器的容积减少一半,则达到新的平衡后,容器内气体的颜色较原平衡时________;(填“变深、变浅或不变”)
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是_________(填字母代号);
a.高温高压 b.加入催化剂 c.减少Z的浓度 d.增加气体Y的浓度
(5)在体积为2L的密闭容器中,充入2mol X和1mol Y进行反应,2min后反应达到平衡,此时平衡混合物中X为0.4mol/L,则Y的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com