

科目:高中化学 来源:山东省高考真题 题型:填空题
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式__________ 从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为_______________
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______________,微粒间存在的作用力是____________。
(3)氧化物MO的电子总数与SiC的相等,则M为_______(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是__________________。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π 键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键。_____________________________________
查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
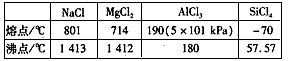
查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
查看答案和解析>>
科目:高中化学 来源:上海高考真题 题型:单选题
查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题

查看答案和解析>>
科目:高中化学 来源:同步题 题型:单选题
查看答案和解析>>
科目:高中化学 来源:期末题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com