
【题目】镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目_____________。
(2)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。还原剂与氧化剂的的物质的量之比为____________。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
【答案】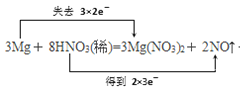 +4H2O NO 氧化性,酸性 3:2 0.2 mol
+4H2O NO 氧化性,酸性 3:2 0.2 mol
【解析】
(1)配平原则:根据得失电子数相等,先配氧化和还原剂、氧化和还原产物,再配平未参加氧化还原反应的元素。Mg元素的化合价由0变化为+2,化合价升高2价,N元素的化合价由+5变为+2,化合价降低3价,化合价升降最小公倍数是6,所以Mg、Mg(NO3)2的系数是3,HNO3、NO的系数是2,反应产生3个Mg(NO3)2中有6个N化合价未发生变化,这部分N也是由硝酸提供,所以应将HNO3的系数由2改为8,根据H原子守恒。可知H2O的系数为4,配平后的方程式为:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O,用双线桥法原则:由氧化剂指向还原产物,还原剂指向氧化产物。桥上注明电子转移数目及“得、失”字样,该题中HNO3为氧化剂,NO为还原产物;Mg为还原剂,Mg(NO3)2为氧化产物。转移电子数6e-,表示为: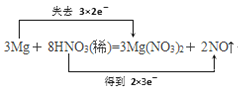 +4H2O;
+4H2O;
(2)在该反应中,氧化剂HNO3化合价降低,生成还原产物NO,所以HNO3为氧化剂,NO为还原产物。化学方程式中8分子HNO3中有6分子生成3个 Mg(NO3)2,生成盐中N元素化合价不变,表现酸性,2个N发生了变化,作氧化剂,所以HNO3的性质表现氧化剂和酸性;方程式中Mg作还原剂,表现还原性,8个HNO3只有2个表现氧化性,所以还原剂与氧化剂的的物质的量之比为3:2;
(3)在反应3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O中转移电子数为6e-,所以若转移的电子为0.6 mol,说明反应的硝酸的物质的量为0.8 mol,其中被还原的硝酸的物质的量是0.2 mol。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】.高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO42-+8H+
B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH-
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体结构的叙述正确的是( )
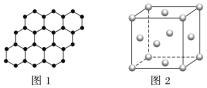
A.SiO2晶体中最小环上的原子个数为6
B.在晶体中只要有阳离子就一定有阴离子
C.12g石墨烯(如图1)中含有六元环的个数为0.5×6.02×1023
D.720gC60晶体中含有0.5×6.02×1023个晶胞(如图2每个小球代表一个C60)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
选项 | 已知条件 | 热化学方程式 |
A | H2的燃烧热为a kJ·mol-1 | H2+Cl2 |
B | 1 mol SO2、0.5 mol O2完全反应,放出热量98.3 kJ | 2SO2(g)+O2(g) ΔH=-98.3 kJ·mol-1 |
C | H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 | H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 |
D | 31 g白磷比31 g红磷能量多b kJ | P4(白磷,s)=4P(红磷,s)ΔH=-4b kJ·mol-1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(4)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
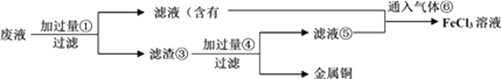
请写出上述实验中加入或生成的有关物质的化学式④____________。
(5)写出向⑤的混合液中通入⑥的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。

②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热测定。

(1)写出该反应的热化学方程式[生成1mol H2O(l)时的反应热为-57.3 kJ·mol-1]________________________。
(2)取50mLNaOH溶液和30 mL硫酸溶液进行实验。
①实验数据如下表,温度差平均值为_________
温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1.0 g·mL-1,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则生成1 mol H2O(l)时的反应热ΔH=_____(列出计算式即可,单位为kJ·mol-1)。
③上述实验数值结果大于-57.3 kJ·mol-1,产生偏差的原因不可能是_____
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是______(填字母)。
A 送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B 把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C 把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D 要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) △H=-890 kJ· mol-1
CO2(g)+2H2O(l) △H=-890 kJ· mol-1
②2H2(g)+O2(g)![]() 2H2O(l) △H=-572 kJ· mol-1
2H2O(l) △H=-572 kJ· mol-1
则反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
(3)CO2催化加氢合成二甲醚是CO2转化的-种方法,主要发生下列反应:
反应I:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41.2 kJ· mol-1
CO(g)+H2O(g) △H=+41.2 kJ· mol-1
反应II:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
在一体积为1 L的恒容密闭容器中,充入1 mol CO2与1 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=![]() ×100%。
×100%。
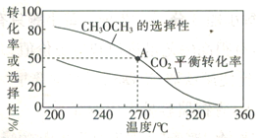
①CH3OCH3的选择性随温度的升高而降低的原因是___________,温度高于300℃时,CO2的平衡转化率随温度的升高而增大的原因是____________。
②270°C时,测得平衡时CH3OCH3的物质的量为0.1 mol,此时n(H2O)=_________mol,反应I的化学平衡常数K=___________(保留两位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1 mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为__________(填“阴极”或“阳极”),生成C2H4的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物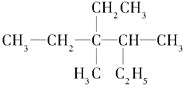 用系统命名法命名:________________________
用系统命名法命名:________________________
(2)写出4甲基2乙基1戊烯的结构简式:________________________
(3)某烃的结构简式是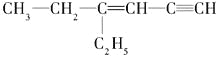 ,分子中饱和碳原子数为_____,可能在同一平面上的碳原子数最多为_________
,分子中饱和碳原子数为_____,可能在同一平面上的碳原子数最多为_________
(4)下列物质中属于同系物的是_________
①CH3CH2Cl ②CH2===CHCl ③CH3CH2CH2Cl ④CH2ClCH2Cl ⑤CH3CH2CH2CH3⑥CH3CH(CH3)2
A.①② | B.①④ | C.①③ | D.⑤⑥ |
(5)0.1 mol某烷烃燃烧,其燃烧产物全部被碱石灰吸收,碱石灰增39g。该烃的分子式为________;若它的核磁共振氢谱共有3个峰,则该烃可能的结构简式为________。(写出其中一种即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com