
下列是反应2A + 3B = C + 4D在不同时刻测得的速率,其中最快的是
A.V(A)=0.6mol/L.s B.V(B)=0.9mol/L.s
C.V(C)=0.4mol/L.s D.V(D)=1.0mol/L.s
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
下列有关香叶醉的叙述正确的是( )
A.香叶醇的分子式为C10H18O B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色D.能发生加成反应不能发生取代反应

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
已二酸是一种重要的化工中间体,可通过氧化环已醇得到。
反应原理为:
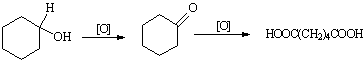
实验步骤:
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后,在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。
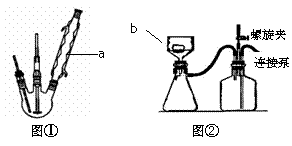

(1)写出实验仪器名称:a ▲ ; b ▲ 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: ▲ 。
(3)步骤3趁热抽滤的目的是: ▲ ;如何证明步骤3滤渣已洗涤干净: ▲ 。
(4)步骤4用盐酸酸化的目的是: ▲ 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li + I2 = 2LiI。下列有关说法正确的是
A.I2发生氧化反应 B.碘电极为该电池的正极
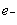 C.正极反应为:Li – = Li+ D.该电池放电时化学能转化为电能
C.正极反应为:Li – = Li+ D.该电池放电时化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下:
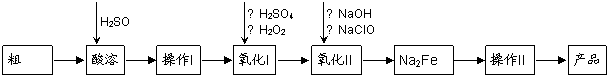 |
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
① Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
请描述随温度变化规律:温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,____________________________________________________。NaClO浓度随温度变化具有上述规律的原因为:____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的
新轨道
C.PCl5分子中P原子和Cl原子最外层都满足8电子结构
D.用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,将等质量的AgCl固体分别加入到等体积的下列4种溶液中,AgCl溶解最少的是
A. 1 mol/L的AlCl3溶液 B. 2mol/L的NaCl溶液
C. 1.4mol/L的BaCl2溶液 D. 1mol/L的MgCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com