
 实验室可以利用图所示装置制取氧气.将3.9g过氧化钠放入烧瓶中,加入100毫升H2O,并用排水法收集气体.(不考虑液体体积变化)
实验室可以利用图所示装置制取氧气.将3.9g过氧化钠放入烧瓶中,加入100毫升H2O,并用排水法收集气体.(不考虑液体体积变化)| 3.9g |
| 78g/mol |
| 1 |
| 2 |


科目:高中化学 来源: 题型:阅读理解
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol?L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
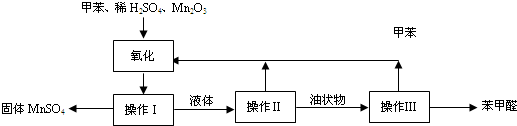
| 反应时间(h) | 1 | 2 | 3 | 4 | 5 |
| 苯甲醛产率(%) | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室可用如图所示的装置制取气体,下列有关说法正确的是( )
实验室可用如图所示的装置制取气体,下列有关说法正确的是( )| A、实验室不能用这种装置来制取氢气 | B、这种装置可以不用加热试管来检查装置的气密性 | C、食盐跟浓硫酸反应制氯化氢的实验能用这种装置 | D、利用这种装置制取乙炔可以随制随停 |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年福建省宁德市高一(下)期末化学试卷(解析版) 题型:解答题
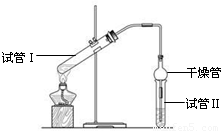
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol?L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com