
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 100mL 0.5mol•L-1KClO3溶液 | ||
| C. | 200mL 0.25 mo l•L-1 KCl溶液 | D. | 100mL 0.5mol•L-1 HCl溶液 |
分析 100ml 0.5mol/L NaCl中Cl-物质的量浓度为0.5mol/L,结合离子浓度=溶质浓度×离子数计算比较,微粒浓度和溶液体积无关.
解答 解:100ml 0.5mol/L NaCl中Cl-物质的量浓度为0.5mol/L,
A.100ml 0.5 mol/L MgCl2 溶液中氯离子的物质的量浓度为0.5 mol/L×2=1mol/L,故A错误;
B.100mL 0.5mol•L-1KClO3溶液中无氯离子,故B错误;
C.200ml 0.25 mol/L KCl溶液中氯离子的物质的量浓度0.25 mol/L×1=0.25mol/L,故C错误;
D.100ml 0.5mol/L HCl溶液中氯离子的物质的量浓度为0.5mol/L,故D正确.
故选D.
点评 本题考查物质的量浓度的相关计算,为高频考点,注意“溶液中离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算,与溶液的体积无关”,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
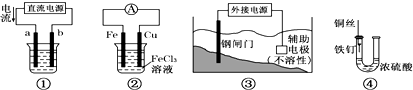
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼粗铜时,粗铜作阳极 | |
| B. | 在原电池中,铜电极只能作正极 | |
| C. | 在镀件上镀铜时,金属铜作阳极 | |
| D. | 锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
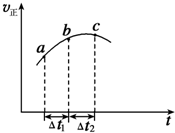 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)| A. | 反应在C点达到平衡状态 | |
| B. | 反应物的总能量大于生成物的总能量 | |
| C. | 反应物浓度:a点大于b点 | |
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
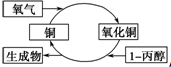
| A. | 反应中有红黑颜色交替变化的现象 | B. | 1-丙醇发生了还原反应 | ||
| C. | 生成物是丙醛和丙酮 | D. | 醇类都能发生图示的催化氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、Cl- | B. | Na+、ClO-、SO42-、Fe2+ | ||
| C. | Ba2+、K+、HCO3-、NO3- | D. | Ba2+、Na+、SO42-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中.Na+一定存在,且浓度为0.1mol/L | |
| B. | 该溶液中CO32-和SO42-一定存在,且物质的量浓度均为0.1mol/L | |
| C. | Ba2+一定不存在 | |
| D. | NH4+ 一定存在,且100mL溶液中物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
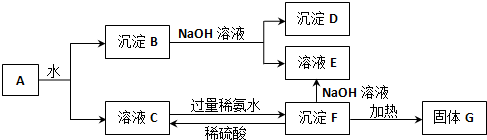
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com