
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |  |  |
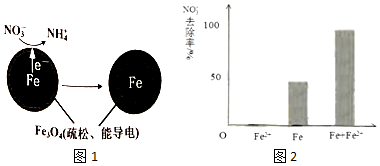
分析 (1)Fe还原水体中NO3-,根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境;
(2)由于Fe3O4为电解质,而电解质主要作用是为电子转移提供媒介,然后根据FeO(OH)不导电进行分析;
(3)根据图2中的三个实验结果进行分析,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高;
(4)根据反应前后原子的种类与数目不发生改变进行判断;
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体,其中Fe元素化合价由+3价变为+6价,所以O元素化合价由-2价变为0价即有氧气生成,根据转移电子守恒、电荷守恒及原子守恒书写方程式.
解答 解:(1)Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极,NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,
故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,将铁全部覆盖阻碍电子转移,所以NO3-的去除率低.
故答案为:因为铁表面生成不导电的FeO(OH),将铁全部覆盖,阻止反应进一步发生;
(3)从图2的实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
(4)根据质量守恒定律,化学反应前后原子的种类和数目不变,每个X中含一个钠原子和一个氯原子,为氯化钠,化学式为NaCl.
故答案为:NaCl;
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体,其中Fe元素化合价由+3价变为+6价,则O元素化合价由-2价变为0价即有氧气生成,则反应的离子方程式为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,
故答案为:4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
点评 本题考查化学反应原理,涉及电化学、氧化还原反应等相关知识,题中的Fe与NO3-的反应跟溶液酸碱性有关,抓住这一点是解题的关键,第Ⅱ问的解答有一定的难度,特别是阐述上的准确性,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 6 | C. | 4 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含Fe3+和NO3-,无I-和Cl- | B. | 含I-,不含Fe3+、NO3-,可能有Cl- | ||
| C. | 含NO3-,不含Fe3+、I-,可能有Cl- | D. | 含I-、Fe3+,不含Cl-,可能有NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1 | B. | 2 mol•L-1 | C. | 4 mol•L-1 | D. | 5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置可构成原电池.试回答下列问题:
如图所示装置可构成原电池.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,CH3COONH4溶液的pH=7,说明等温等浓度的CH3COOH和NH3•H2O的电离度相等 | |
| B. | 锅炉中沉积的CaSO4可用稀Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| C. | 向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶液中c(CO32-)=c(HCO3-) | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molH2、2molN2 | 4molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| N2的体积分数 | w 1 | w 2 | w 3 |
| 混合气体的密度(g•L-1) | ?ρ1 | ?ρ2 | ?ρ3? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com