
已知CO2和SO2的化学性质具有相似性和差异性。
(1)写出CO2与 Na2O2反应的化学方程式___________________________。
(2)某学生判断SO2和Na2O2反应可能生成硫酸钠。
① 你认为他的判断合理吗? ,简要说明理由: 。
② 该同学为了确认SO2和Na2O2反应中是否有氧气生成吗,拟使用下列装置进行实验。
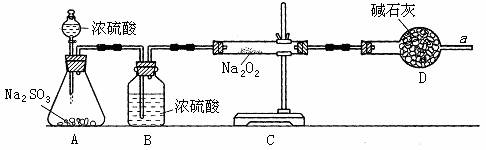
B装置的作用是 ;
D装置的作用是 。
③ 为确认SO2和Na2O2反应的产物,该同学设计了以下实验操作,你认为应该进行的操作(按先后顺序排列)是 (填序号)。
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧。
B.将C装置中反应后的固体物质溶于适量水配成溶液。
C.在配成的溶液中加入用硝酸(氧化性酸)酸化的硝酸钡溶液,观察是否有沉淀生成。
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
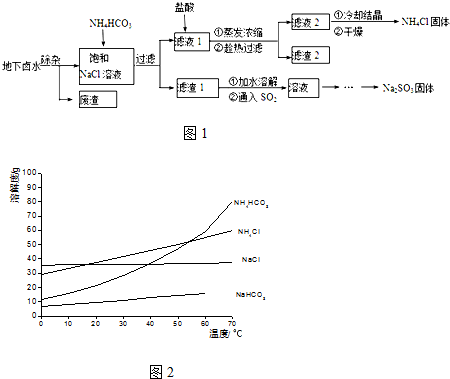
| 物质 | 电离常数(25℃) |
| H2CO3 | K1=4.4×10-7K2=4.7×10-11 |
| H2SO3 | K1=1.23×10-2K2=5.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
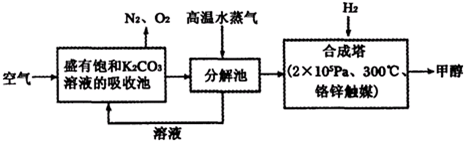
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.2 | 0.4 |
查看答案和解析>>
科目:高中化学 来源:2015届云南省高二上学期期中考试化学试卷(解析版) 题型:填空题
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g);△H= ;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位);
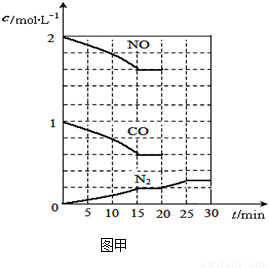
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
A.加入催化剂 B.降低温度 C.缩小容器体积 D.增加CO2的量
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从 而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
查看答案和解析>>
科目:高中化学 来源:重庆一中2012级高一2010年4月月考 题型:填空题
已知CO2和SO2的化学性质具有相似性和差异性。
(1)写出CO2与 Na2O2反应的化学方程式___________________________。
(2)某学生判断SO2和Na2O2反应可能生成硫酸钠。
① 你认为他的判断合理吗? ,简要说明理由: 。
② 该同学为了确认SO2和Na2O2反应中是否有氧气生成吗,拟使用下列装置进行实验。
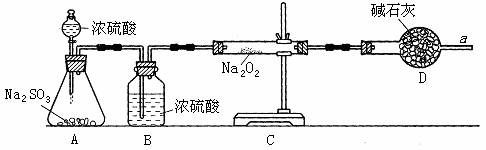
B装置的作用是 ;
D装置的作用是 。
③ 为确认SO2和Na2O2反应的产物,该同学设计了以下实验操作,你认为应该进行的操作(按先后顺序排列)是 (填序号)。
A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧。
B.将C装置中反应后的固体物质溶于适量水配成溶液。
C.在配成的溶液中加入用硝酸(氧化性酸)酸化的硝酸钡溶液,观察是否有沉淀生成。
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com