
科目:高中化学 来源: 题型:
 2NH3(g)△H<0,则该反应的△H为( )
2NH3(g)△H<0,则该反应的△H为( )查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省四地六校高二上学期第二次月考化学试卷(解析版) 题型:填空题
工业上合成氨的热反应方程式如下:N2(g)+3H2(g)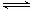 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
(1)若已知破坏1mol 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为
kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为
kJ。
(2)在恒温恒压的条件下,将2mol N2和6molH2通入一容积可变的容器中反应,达到平衡后气体的体积为反应前的75%,则该过程释放的能量为 kJ,氮气的转化率为 ,平衡后氨气占混合气体的体积分数为 。
(3)若将1mol N2和1molH2通入两个相同体积的密闭容器甲和乙中,甲容器保持温度和体积不变,乙容器保持温度和压强不变,经过一段时间后,两容器均达到平衡状态。
①建立平衡所需的时间:甲 乙(填“>”,“<”或“=”)
②达到平衡后氨气的体积分数:甲 乙(填“>”,“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com