
下列选项中所涉及的两个量一定相等的是
A.11.2  L Cl2与4.25 g NH3所含有的原子数
L Cl2与4.25 g NH3所含有的原子数
B.等质量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
C.标准状况下36 g H2O与1.204×1024个O2分子所占的体积
D.18.0 g重水(D2O)与20 g Ne所含有的电子数
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2015-2016学年辽宁省高二上10月月考化学试卷(解析版) 题型:填空题
(12分)2014年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
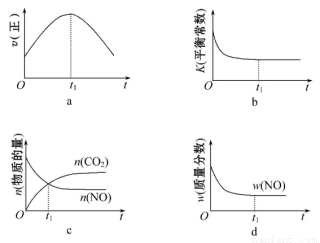
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:

①该反应的ΔH 0(填“>”“<”)。
②在T2温度下,0~2 s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)ΔH1
2CO(g)+O2(g)===2CO2(g)ΔH2
2H2(g)+O2(g)===2H2O(g)ΔH3
则反应CO(g)+2H2(g)===CH3OH(g)的ΔH=___ 。
(3)某实验小组用50mL 0.50mol·L- 1 NaOH 溶液和30mL 0.50mol·L- 1硫酸溶液进行中和热的测定。实验数值结果比57.3 kJ/mol偏小,产生此实验偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省牡丹江市高三9月月考化学试卷(解析版) 题型:选择题
下列离子方程式与所述事实相符且正确的是
A.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=== 4Fe3++6Cl-+Br2
B.磁性氧化铁溶于氢碘酸:Fe3O4+8H+=== 2Fe3++Fe2++4H2O
C.放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2===2I2+2H2O[来
D.向硝酸铵溶液中滴加NaOH溶液:NH4++OH-=== NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一下期末化学试卷(解析版) 题型:填空题
(6分)将两张圆形滤纸分别折叠成漏斗状,套在一起使四周都是四层,把内层纸漏斗取出,在底部剪一个孔,用水湿润,再与另一纸漏斗套在一起,架在铁架台的铁圈上,下面放有盛有细沙的蒸发皿,将5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在纸漏斗中,引发铝热反应。完成下列问题。
(1)上述反应的化学方程式为_______________,铝热反应可用于________(填写一种用途)。
(2)引发铝热反应的实验操作是________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一下期末化学试卷(解析版) 题型:选择题
下列关于常见有机物的说法不正确的是
A.乙酸和油脂都能与NaOH溶液反应
B.蛋白质、纤维素、蔗糖、油脂都是高分子化合物
C.淀粉水解与纤维素水解得到的最终产物相同
D.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二9月月考化学试卷(解析版) 题型:选择题
下图曲线a表示反应X(g)+Y(g) +N(s)  Z(g)+M(g) △H<0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g) △H<0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
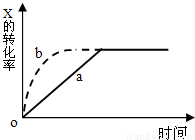
A.升高温度
B.加大N的投入量
C.缩小体积
D.加大X的投入量
查看答案和解析>>
科目:高中化学 来源:2016届浙江省富阳市高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.酸性高锰酸钾与少量双氧水反应:2MnO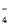 +7H2O2+6H+= 2Mn2++6O2↑+10H2O
+7H2O2+6H+= 2Mn2++6O2↑+10H2O
B.用石墨电极电解饱和MgCl2溶液:2Cl-+ 2H2O  2OH-+ Cl2↑+ H2↑
2OH-+ Cl2↑+ H2↑
C.Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++ HCO+OH—=MgCO3↓+H2O
D.向NaClO溶液中通入过量CO2;CO2+ClO—+H2O=HCO3-+HClO
查看答案和解析>>
科目:高中化学 来源:2016届河南省三门峡市高三上学期第一次精英对抗赛化学试卷(解析版) 题型:填空题
(10分) 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + a Na2O2 = 2Na2FeO4 + b X + 2Na2SO4 + c O2↑
①该反应中物质X应是 ,a与c的关系是 。
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成1mol FeO42-转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期中测试化学试卷(解析版) 题型:选择题
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com