
| A. | 冶炼过程中的尾气可用来制硫酸 | |
| B. | 上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g |
分析 A.尾气中含有二氧化硫,可用作制造硫酸;
B.依据方程式:2CuFeS2+4O2═Cu2S+3SO2+2FeO、2Cu2S+3O2═2Cu2O+2SO2;2Cu2O+Cu2S═6Cu+SO2↑计算解答;
C.依据氧化亚铜在反应中化合价变化判断;
D.电解精炼铜的过程中,阳极溶解的不全都是铜.
解答 解:A.炼过程中的尾气含有二氧化硫,可用来制硫酸,故A正确;
B.依据给出方程式可知,反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,由1molCuFeS2制取1molCu时,共消耗2.5molO2,故B错误;
C.2Cu2O+Cu2S═6Cu+SO2↑,反应中铜化合价降低,氧元素化合价不变,所以氧化亚铜只做氧化剂,故C错误;
D.电解精炼铜的过程中,阳极溶解的不都是铜,所以每转移1mol电子时,阳极溶解铜的质量不是32g,故D错误;
故选:A.
点评 本题考查金属的冶炼以及氧化还原有关知识,熟悉氧化还原反应基本概念和规律即可解答,题目难度不大.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
 大气压强对许多物理实验和化学实验有着重要影响.
大气压强对许多物理实验和化学实验有着重要影响.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制Cu(OH)2浊液可鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液 | |
| B. | 用无水乙醇、冰醋酸、3mol/L硫酸制乙酸乙酯 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 可用分液漏斗分离甘油和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的生成速率与I2的生成速率相等 | |
| B. | 若单位时间内生成n mol H2的同时生成2n mol HI | |
| C. | H2、I2、HI的浓度相等 | |
| D. | 反应容器内的压强不随时间的变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
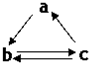 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 无色透明的水溶液中:K+、Mg2+、I-、Cl- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com