
| A. | 加入适量水 | B. | 加入少量盐酸 | C. | 加入适量KOH固体 | D. | 加热 |
分析 如果要使c(CO32-)更接近0.1mol/L,则抑制CO32-+H2O?HCO3-+OH-,即平衡逆向移动,以此来解答.
解答 解:A.加水促进水解,且c(CO32-)减小,故A不选;
B.加入少量盐酸促进水解,且c(CO32-)减小,故B不选;
D.加入适量KOH固体,CO32-+H2O?HCO3-+OH-平衡逆向移动,c(CO32-)更接近0.1mol/L,故C选;
D.加热促进水解,c(CO32-)减小,故D不选;
故选C.
点评 本题考查平衡移动原理的应用,为高频考点,把握水解反应的影响因素及平衡移动为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
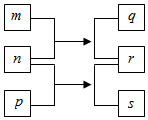 W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | Y的氢化物的沸点比Z的氢化物的沸点高 | |
| C. | 通常状况下,X的氢化物可能呈气态、液态或固态 | |
| D. | 由W、X、Y、Z四种元素只能组成一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
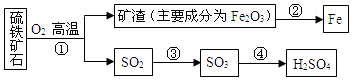
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
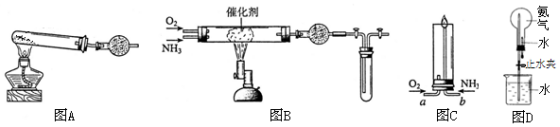
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将溶液不断加水稀释,则水的电离程度增大 | |
| B. | 溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-) | |
| C. | 若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a | |
| D. | 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8mol/L时即能产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| B. | 水的离子积常数Kw与温度无关 | |
| C. | 溶液中c(Ag+)•c(Cl-)大于Ksp时,将产生AgCl | |
| D. | 难溶电解质AB2饱和溶液中,c(A2+)=xmol/L,c(B-)=ymol/L,则Ksp值为xy |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的晶体硅可以制备晶体管等半导体、电脑芯片和光导纤维 | |
| B. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| C. | 受强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| D. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com