
某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。经小组讨论,他们设计 了如下装置进行实验。 烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1、C4中装有碱石灰,试管E1、E3、E4中装有澄清石灰水。
了如下装置进行实验。 烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1、C4中装有碱石灰,试管E1、E3、E4中装有澄清石灰水。
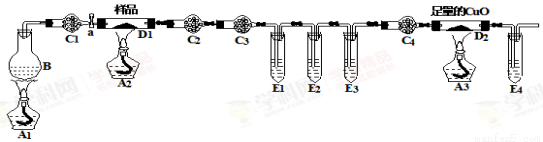
(1)充分反应后,将D1中的固体残余物投入足量经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为 (写化学式)。
(2)该装置中有3个酒精灯,整个实验过程至少应 该点 次酒精灯,最后一次点燃的是 。(填酒精灯下的字母)
该点 次酒精灯,最后一次点燃的是 。(填酒精灯下的字母)
(3)该实验装置中有4个直立的试管,它们与盛放试剂体现不同的作用,其中E3的作用是: 。
(4)该实验装置中有4个干燥管,C3中盛装的试剂是 。
(5)取7.2 g样品充分反应后,测得D1中的固体残余物为2.88 g,D2中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的方程式为 。
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
下列反应既是氧化还原反应,又是放热反应的是( )
A.氢氧化钠与稀硫酸反应
B.钠箔在Cl2中的燃烧
C.Ba(OH)2•8H2O与NH4Cl的反应
D.灼热的炭与水蒸气反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
常温下a mol/L稀氨水和b mol/L稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
A.若a<b,则c(OH-)<c(H+) B.若a=b,则c(NH4+)=c(Cl―)
C.若a>b,则c(NH4+)>c(Cl―) D.若a>b,则c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(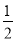 ,
,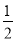 ,
,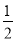 )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目:高中化学 来源:2017届广东省广州市高三12月模拟化学试卷(解析版) 题型:选择题
用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
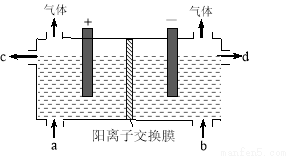
A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂 B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮 D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
已知稀溶液中,盐酸与氢氧化钠反应生成1molH2O时放热55.6 kJ ;1mol H2SO4(aq)与1mol Ba(OH)2(aq)反应的ΔH=-1584.2kJ/mol;则稀溶液中,Na2SO4与BaCl2反应生成1mol BaSO4(s)的反应热等于( )
A.-1528.6 kJ/mol B.-1639.8 kJ/mol C.-1473 kJ/mol D.-1695.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三12月月考化学试卷(解析版) 题型:简答题
锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与 Ca 和Ba同属于同族。
(1)Sr 的原子序数是 ,碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
I.将天青石矿粉和Na2CO3溶液充分混合,过滤;
II.将滤渣溶于盐酸,过滤;
III.向Ⅱ所得滤液中加入浓硫酸,过滤;
IV.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
V.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:i.相同温度时的Ksp :BaSO4<SrCO3<SrSO4<CaSO4
ii.生成氢氧化物沉淀的pH
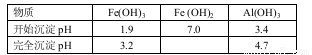
已知氢氧化亚铁的溶度积为1×10—15则Fe2+完全沉淀的pH值为 (完全沉淀时Fe2+的浓度小于1×10—5)
①I中,反应的化学方程式是 。
②II中,能与盐酸反应溶解的物质有 。
③加入次氯酸的有关离子方程式为 ;IV加入氨水的目的是 。
④下列关于该工艺流程的说法正确的是 。
a.该工艺产生的废液含较多的Na+ 、Cl- 、SO42-
b.V中反应时,升高温度一定可以提高SrCO3的生成速率
c.V中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:选择题
下列有关金属的工业制法中正确的是( )
A.制钛:用金属钠置换四氯化钛(TiCl4)溶液中的钛
B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com