
����Ŀ��(1)�״�![]() ����Ҫ���ܼ������ȼ�ϣ���ҵ����CO��H2��һ���������Ʊ�
����Ҫ���ܼ������ȼ�ϣ���ҵ����CO��H2��һ���������Ʊ�![]() �ķ�Ӧ��
�ķ�Ӧ��![]() �������Ϊ1L�ĺ����ܱ������У���2molCO��
�������Ϊ1L�ĺ����ܱ������У���2molCO��![]() ��һ�������·���������Ӧ�����
��һ�������·���������Ӧ�����![]() ��
��![]() ��Ũ����ʱ��仯��ͼ��ʾ��
��Ũ����ʱ��仯��ͼ��ʾ��
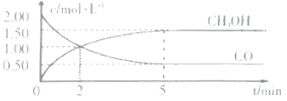
�ٴӷ�Ӧ��ʼ��5min����һ����̼��ʾ��ƽ����Ӧ��������CO��=______��
������˵����ȷ����______��
A.�ﵽƽ��ʱ��![]() ��ת����Ϊ
��ת����Ϊ![]()
B.5min�������л�������ƽ����Է����������ٸı�
C.�ﵽƽ����ٳ��백������Ӧ���ʼ�С
D.2minǰ��������>�����棩��2min����������<�����棩
(2)һ���¶��£���![]() ��
��![]() �������1��2�����ܱ������з�����Ӧ��
�������1��2�����ܱ������з�����Ӧ��
![]() ���ﵽƽ��ʱ
���ﵽƽ��ʱ![]() ���������Ϊ
���������Ϊ![]() ���÷�Ӧ��ƽ�ⳣ��
���÷�Ӧ��ƽ�ⳣ��![]() ______��
______��
(3)̼��ˮ������Ӧ��ȡ![]() ����ط�Ӧ���£�
����ط�Ӧ���£�
��![]()
��![]()
��![]()
�ټ��㷴Ӧ![]() ��
��![]() ______
______![]()
�ڶ��ڿ��淴Ӧ![]() ����ȡ���´�ʩ�������
����ȡ���´�ʩ�������![]() ���ʵ���______��
���ʵ���______��
A.������ϵ���¶�
B.ѹ�����������
C.����CaO����
D.ѡ���ʵ��Ĵ���
(4)�Լ״�Ϊȼ�ϣ�![]() Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ��
Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ��![]() �缫����Ϊ���Ե缫
�缫����Ϊ���Ե缫![]() ����KOH��Һ������д����ȼ�ϵ�ظ����ĵ缫��Ӧʽ��______��
����KOH��Һ������д����ȼ�ϵ�ظ����ĵ缫��Ӧʽ��______��
(5)����20mL![]() ������
������![]() ��Һ����μ���һ��Ũ�ȵ��ռ���Һ����û����Һ���¶ȱ仯��ͼ��ʾ�������й�˵����ȷ����______
��Һ����μ���һ��Ũ�ȵ��ռ���Һ����û����Һ���¶ȱ仯��ͼ��ʾ�������й�˵����ȷ����______
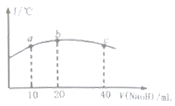
�ٸ��ռ���Һ��Ũ��Ϊ![]()
�ڸ��ռ���Һ��Ũ��Ϊ![]()
��![]() �ĵ���ƽ�ⳣ����b��
�ĵ���ƽ�ⳣ����b��![]() ��
��
�ܴ�b�㵽c�㣬�����Һ��һֱ���ڣ�c(Na+)>c(NO2-)>c(OH-)>c(H+)
���𰸡�![]() B
B ![]()
![]() A
A ![]() �ڢ�
�ڢ�
��������
��1���ٸ���ͼ�������ݺͻ�ѧ��Ӧ���ʵĹ�ʽ���㣻
�ڽ��ͼ����й����ݹ�ϵ���м��㣬���ݻ�ѧƽ��״̬�ı�־�����жϣ�
��2����������ʽ���м��㣻
��3���ٸ��ݸ�˹���ɽ��м��㣻
�ڸ���Ӱ�컯ѧƽ���ƶ������ط����жϣ�
��4��CH3OH�ڸ�������ʧ���ӵ�������Ӧ���ݴ���д�缫��Ӧʽ��
��5��b���¶���ߣ�˵����ʱNaOH��NaNO2ǡ����ȫ��Ӧ���ݴ˷����жϡ�
��1���ٸ���ͼ������CO��=![]() mol/(L��min)=0.3 mol/(L��min)��
mol/(L��min)=0.3 mol/(L��min)��
��A.����ƽ��ʱ���������������ʵ���Ũ��Ϊ2��(2��0.5)mol��L��1=3mol��L��1��������ת����Ϊ![]() ��100%=75%��ѡ��A����
��100%=75%��ѡ��A����
B.������������ʼ�ղ��䣬���÷�Ӧ���������ʵ������ٵķ�Ӧ����˻�������ƽ����Է�����������ʱ��˵���ﵽƽ�⣬��5minʱ����Ӧ�ﵽƽ�⣬ѡ��B��ȷ��
C.����״̬�£�����NH3�������Ũ�Ȳ��䣬��ѧ��Ӧ���ʲ��䣬ѡ��C����
D.5minʱ��Ӧ�ﵽƽ�⣬5minǰ��Ϊ��( ��)>��(��)��ѡ��D����
��ѡB��
��2����Ϊ�÷�Ӧ��Ӧǰ��������������䣬����NO2�����ʵ���Ũ��Ϊ1mol/L��SO2�����ʵ���Ϊ2mol/L��
��������ó�![]() ��100%=25%�����x=0.75�����ݻ�ѧƽ�ⳣ���Ķ��壬
��100%=25%�����x=0.75�����ݻ�ѧƽ�ⳣ���Ķ��壬![]() �������K=
�������K=![]() =1.8��
=1.8��
��3���ٸ��ݸ�˹���ɣ���I+II��III�ó���H=(131��43��178.3)kJ��mol��1=��90.3kJ��mol��1��
��A.����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ������У������IJ������ӣ�ѡ��A�ɲ�ȡ��
B.��Ӧǰ������ϵ��֮����ȣ�ѹ�������������ƽ�ⲻ�ƶ�����H2�IJ��ʲ��䣬ѡ��B���ɲ�ȡ��
C.CaO�ǹ��壬Ũ����Ϊ������������CaO����ƽ�ⲻ�ƶ���H2�IJ��ʲ��䣬ѡ��C���ɲ�ȡ��
D.������ƽ����ƶ���Ӱ�죬H2�IJ��ʲ��䣬ѡ��D���ɲ�ȡ��
��ѡA��
��4���Լ״�Ϊȼ�ϣ�![]() Ϊ��������KOH��ҺΪ�������Һ��ͨ�״�һ��Ϊ�����������缫��ӦʽΪ
Ϊ��������KOH��ҺΪ�������Һ��ͨ�״�һ��Ϊ�����������缫��ӦʽΪ![]() ��
��
��5���٢ڵ�����20mL����������Һʱ���¶ȴﵽ��ߣ�����ǡ����ȫ��Ӧ����NaOH��Ũ��Ϊ0.01mol��L-1���ٴ�����ȷ���۵���ƽ�ⳣ�����¶ȵ�Ӱ�죬������ʵĵ��������ȹ��̣������¶ȴٽ����룬b���¶ȱ�a��ߣ����b��HNO2�ĵ���ƽ�ⳣ����a�����ȷ���ܴ�b�㵽c�㣬��c����Һ������ΪNaNO2��NaOH�����������ʵ�����ȣ���ʱ������Ũ�ȴ�С˳���ǣ�c(Na��)>c(OH��)>c(NO2��)>c(H��)���ܴ���
��ѡ�ڢۡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ��ʵ��װ������ⱥ��ʳ��ˮ�������������������������(Լ6 mL)�ͼ���������������(��Ӧ��������������������)��
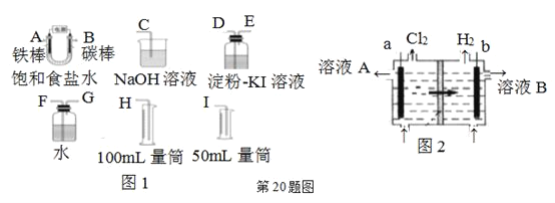
��1���Դ���ͼͼ1��ѡ�ü��ֱ�Ҫ������,����һ����װ��,���������ӿڵ�����˳��(����)��:A��________,B��________��
��2��������ֱ����Դ��________��;̼���Ϸ����ĵ缫��ӦΪ________��
��3����˵���������������Ե�ʵ��������________��
��4���ٶ�װ��ı���ʳ��ˮΪ50 mL(���ǰ����Һ����仯�ɺ���),����õ�����Ϊ5.6 mL��������ɱ�״����ʱ,��Һ��pHΪ________��
��5����ҵ�ϲ������ӽ���Ĥ����ⱥ��ʳ��ˮ������ͼͼ2�������ӽ���Ĥ��________��������������������������������Ĥ����ҺA��________�������ʵĻ�ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�絼��Խ������Խǿ����������0.100 mol��L-1NaOH��Һ�ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.100 mol��L-1������ʹ�����Һ����õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ����

A. ���ߢٴ����ζ����������
B. �ζ�����Ĺ���Ӧ��ѡ�������Ϊָʾ��
C. a��b��c������Һ��ˮ�ĵ���̶ȣ�c>a>b
D. b����Һ�У�c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.2mol/LһԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ����

A. HA��ǿ��
B. �û��ҺpH=7
C. ͼ��x��ʾHA��Y��ʾOH-��Z��ʾH+
D. �û����Һ�У�c(A-)+c(Y)=c��Na+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaOH��Һ�����ڶ�������Ĵ�����
(1)CO2���������壬����NaOH��Һ���յõ�Na2CO3��NaHCO3��
��Na2CO3�׳ƴ����CO32��ˮ���ʹ��ˮ��Һ�ʼ��ԣ�д��CO32����һ��ˮ������ӷ���ʽ_________����֪25��ʱ��CO32����һ��ˮ���ƽ�ⳣ��Kh=2��10��4mol/L������Һ��c��HCO3������c��CO32����=20��1 ʱ����Һ��pH=_____��
����ĭ�������ͨ��װ��NaHCO3 ��Һ��Al2(SO4)3��Һ����д����������Һ���ʱ�����ӷ�Ӧ����ʽ__________��
(2)������Ũ���ᷴӦ������NO2����NaOH��Һ���գ���Ӧ����ʽΪ��2NO2+2NaOH=NaNO3+NaNO2+H2O����0.2molNaOH��ˮ��Һ��0.2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ҺBΪ0��lmolL��1CH3COONa��Һ����������Һ��c��NO3������c��NO2������c��CH3COO�����ɴ�С��˳��Ϊ___________����֪HNO2�ĵ��볣��Ka=7.1��10��4molL��1��CH3COOH�ĵ��볣��Ka=1.7��10��5molL��1������ʹ��ҺA����ҺB�� pH��ȵķ�����_____��
A������ҺA�м�����NaOH B������ҺA�м�����ˮ
C������ҺB�м�����NaOH D������ҺB�м�����ˮ
(3)�����е�SO2���������꣬����������������Һ���ա�����SO2�Ĺ����У���Һ��H2SO3��HSO3����SO32��������ռ���ʵ���������a����pH�仯�Ĺ�ϵ��ͼ��ʾ��

��ͼ��pH=7ʱ����Һ������Ũ�ȹ�ϵ��ȷ����___��
A��c��Na+����2c��SO32������c��HSO3����
B��c��Na+��=c��SO32����+c��HSO3����+c��H2SO3��
C��c��OH����=c��H+��+c��H2SO3��+c��HSO3����
D��c��Na+����c��HSO3������c��SO32������c��H+��=c��OH����
��������ͼ�����ݣ���ӦH2SO3![]() H++ HSO3����ƽ�ⳣ������ֵ____��
H++ HSO3����ƽ�ⳣ������ֵ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������з�����Ӧ��3Z��s��![]() X��g����2Y��g����H��a kJ��mol��1��a��0��������˵������ȷ����
X��g����2Y��g����H��a kJ��mol��1��a��0��������˵������ȷ����
A.��0.3 mol Z���������г�ַ�Ӧ������������ʵ���һ��С��0.3 mol
B.�ﵽ��ѧƽ��״̬ʱ������ƽ��Ħ����������
C.�����з���3mol Z���ﵽ��ѧƽ��״̬ʱ����Ӧ���յ�������Ϊa kJ
D.�����¶Ȳ��䣬��Ӧ�Ѿ��ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������İ���������������Ƶ��ܱ����������![]() ��������������䣬��������������Բ���
��������������䣬��������������Բ���![]() ��ʹ��ﵽ�ֽ�ƽ�⣺
��ʹ��ﵽ�ֽ�ƽ�⣺![]() ��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶� |
|
|
|
|
|
ƽ��������Ũ�� |
|
|
|
|
|
�����й�������ȷ����
A.�ÿ��淴Ӧ�ﵽƽ��ı�־֮һ�ǻ������ƽ����Է�����������
B.��÷�Ӧ![]() ��
��![]() �������ڵ������Է�����
�������ڵ������Է�����
C.�ﵽƽ������ں�����ѹ�������������ϵ�������Ũ������
D.���ݱ������ݣ�����![]() ʱ�ķֽ�ƽ�ⳣ��ԼΪ
ʱ�ķֽ�ƽ�ⳣ��ԼΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������
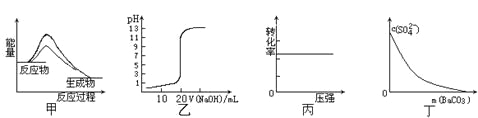
A.ͼ�ױ�ʾʹ�ô����÷�Ӧ����H��С
B.ͼ�ұ�ʾ0��10mol��L-1NaOH��Һ�ζ�20��00mL0��10mol��L-1CH3COOH��Һ���õ��ĵζ�����
C.ͼ����ʾ��ӦH2(g) + I2(g)![]() 2HI(g)��H2��ת������ѹǿ�ı仯
2HI(g)��H2��ת������ѹǿ�ı仯
D.ͼ����ʾ�ڱ���Na2SO4��Һ����BaCO3�������Һ��c(SO42-)��Ũ�ȱ仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com