
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH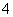 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO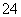 、NO
、NO 、OH-、CO
、OH-、CO 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成;
②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)D的化学式是______,判断理由是__________________________________________________
__________________________________________________。
(2)写出其余几种物质的化学式:A____________________,B____________________,C____________________。
(3)写出实验②中有关反应的离子方程式__________________________________________________
__________________________________________________。
解析 解答推断类题目的关键是找到突破口。D和A、B都能生成气体,而题给离子中只有H+与CO 、OH-与NH
、OH-与NH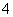 能反应生成气体,故D只能为(NH4)2CO3;在A或D中滴入C,均有沉淀生成,说明A中含有SO
能反应生成气体,故D只能为(NH4)2CO3;在A或D中滴入C,均有沉淀生成,说明A中含有SO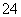 ,C中应含有Ba2+,而A和D反应生成的气体说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠。
,C中应含有Ba2+,而A和D反应生成的气体说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠。
答案 (1)(NH4)2CO3 D和A、B都能生成气体,而题给离子中只有H+与CO 、OH-与NH
、OH-与NH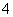 能反应生成气体,D只能为(NH4)2CO3 (2)H2SO4 NaOH Ba(NO3)2
能反应生成气体,D只能为(NH4)2CO3 (2)H2SO4 NaOH Ba(NO3)2
(3)NH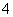 +OH-
+OH-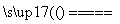 NH3↑+H2O,NH3+H+===NH
NH3↑+H2O,NH3+H+===NH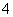


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下:
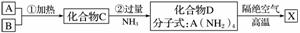
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可作光导纤维。
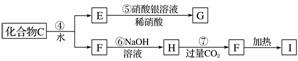
按要求回答下列问题:
(1)C的化学式为________;X的化学式为________。
(2)写出下列方程式:
反应②的化学方程式_____________________________;
反应⑦的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为__________________,A与B在原子的电子层结构上的相同点是________________________________________________________________________
________________________________________________________________________。
(2)易与C发生化学反应的酸是________(写名称),反应的化学方程式是________________________________________________________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:___________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式书写正确的是( )
A.将Al条投入NaOH溶液中:Al+OH-+H2O===AlO +H2↑
+H2↑
B.铜溶于稀硝酸中:Cu+4H++2NO ===Cu2++2NO2↑+2H2O
===Cu2++2NO2↑+2H2O
C.碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO +OH-===CO
+OH-===CO +H2O
+H2O
D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO +CH3COOH===CH3COO-+HCO
+CH3COOH===CH3COO-+HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
卫生部发出公告,自2012年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是 ( )。
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1∶1
C.CaO2与水反应时,每产生1 mol O2转移电子4 mol
D.CaO2与CO2反应的化学方程式为2CaO2+2CO2===2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是__________________
________________________________________________________________________。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2—→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。模拟工业制备氢溴酸的流程如图所示:
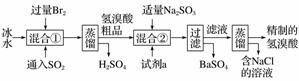
回答下列问题:
(1)混合①中发生反应的离子方程式为___________________。
(2)混合②中加入试剂a是________________________。
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是____________________________(请用离子方程式表示)。
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因。该试剂是____(填字母)。
a.KMnO4溶液 b.NaOH溶液
c.KSCN溶液 d.淀粉KI溶液
e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铝单质的化学性质以相似为主,但也存在某些重大差异性,下列物质能用于证明二者存在较大差异性的是( )
①CO2 ②盐酸 ③NaOH溶液 ④水
A.①④ B.②③ C.①③ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com