
【题目】氯气是一种黄绿色气体.1974年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
(1)若用这两种方法制氯气,请比较,它们的发生装置使用的不同仪器是 .
(2)现将29g纯度为60%的软锰矿(主要成分MnO2)与足量的浓盐酸充分反应(杂质不参加反应),把反应后所得溶液稀释到200mL.计算:
①生成的Cl2在标准状况下的体积.
②稀释后溶液中MnCl2的物质的量浓度.
【答案】
(1)前者需要酒精灯加热,后者不需要
(2)
解:①29g纯度为60%的软锰矿(主要成分MnO2)中MnO2的物质的量为: ![]() mol=0.2mol,则:
mol=0.2mol,则:
MnO2+ | 4HCl(浓) |
| MnCl2+ | Cl2↑ | +2H2O |
1 | 1 | ||||
0.2mol | n(Cl2) |
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
②消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2)=0.2mol,将反应后所得溶液稀释成200mL,稀释后液中MnCl2的物质的量浓度为 ![]() =1mol/L,
=1mol/L,
答:稀释后液中MnCl2的物质的量浓度为1mol/L
【解析】解:(1)软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,需在加热条件下进行;用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O,该反应无需加热,所以它们的发生装置使用的不同仪器是前者需要酒精灯加热,后者不需要,故答案为:前者需要酒精灯加热,后者不需要;
MnCl2+Cl2↑+2H2O,需在加热条件下进行;用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O,该反应无需加热,所以它们的发生装置使用的不同仪器是前者需要酒精灯加热,后者不需要,故答案为:前者需要酒精灯加热,后者不需要;
(1)根据反应条件确定制备装置的异同之处;(2)①根据质量分数计算软锰矿中二氧化锰的质量,再根据n= ![]() 计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
②消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2),根据c= ![]() 计算稀释后液中MnCl2的物质的量浓度.
计算稀释后液中MnCl2的物质的量浓度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源开发利用,关于其有利因素的下列说法,你认为哪项是错误的( )
A.铝质轻,便于运输、贮存,且安全
B.铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制
C.在地球上,铝矿资源比较丰富
D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成以下计算:
(1)3.01×1023个氨分子的质量为: .
(2)标准状况下,L氨气中氢原子数与98g的硫酸中氢原子数相同.
(3)2.4mol Cl2与元素R单质完全反应生成1.6mol RClx,则x值为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读分析下列材料:
材料1:纯碱和氯化钠溶解度随温度变化的曲线图: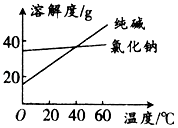
材料2:两种有机物的物理性质:
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,合适的方法是(填字母,下同);将乙二醇和丙三醇混合液相互分离的最佳方法是: .
A、萃取 B、蒸馏 C、溶解、蒸发浓缩、冷却结晶、过滤 D、分液
(2)某纯碱样品中可能含有氯化钠,设计一个简易实验加以证明: . (写出简要操作方法、现象和结论)
(3)某同学设计两套方案测定纯碱样品(含少量的氯化钠)中碳酸钠的质量分数.
方案1:取mg纯碱样品,加入过量的盐酸,充分反应后,蒸发、灼烧、称重得bg固体,计算出纯碱样品纯度.
方案2:取mg纯碱样品,溶于水加入过量的氯化钙溶液,过滤、洗涤、烘干、称重得ag固体,计算出纯碱样品纯度.
①写出方案1涉及的反应的化学方程式:;
②利用方案2中的数据计算该纯碱的纯度: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由溴乙烷制取乙二醇(HOCH2CH2OH),依次发生的反应类型是( )
A.取代 加成 水解B.消去 加成 水解
C.水解 消去 加成D.消去 水解 取代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c (H+)增大,Kw不变
B. 向水中加入氨水,平衡逆向移动,c (OH-)降低
C. 向水中加入金属钠,平衡逆向移动,c (H+)减小
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。


(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I的反应速率v(I)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 molL-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com