
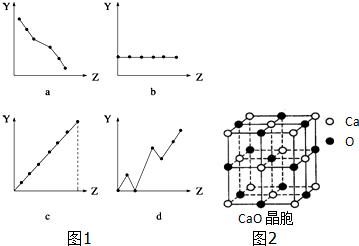
分析 (1)①ⅡA族元素的价电子数均为2;
②第3周期主族元素的最高化合价由+1升高为+7;
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大,Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O元素;M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si,N-、Z+、X+的半径逐渐减小,XN常温下为气体,故N为氯,Z为钠,X为氢.
③中根据均摊法计算晶胞中钙原子、氧原子数目,进而计算晶胞质量,再根据V=$\frac{m}{ρ}$计算晶胞体积.
解答 解:(1)①ⅡA族元素的价电子数均为2,随原子序数的增大而价电子不变,只有b符合,故答案为:b;
②第3周期主族元素的最高化合价由+1升高为+7,只有c符合,故答案为:c;
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大,Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O元素;M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si,N-、Z+、X+的半径逐渐减小,XN常温下为气体,故N为氯,Z为钠,X为氢.
①由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小,则A为NaOH,B为NaClO,
故答案为:NaClO;
②工业上用焦炭高温下还原二氧化硅来制备硅,方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO;
③晶胞中钙原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧原子数目为1+12×$\frac{1}{4}$=4,故晶胞质量为4×$\frac{56}{{N}_{A}}$g,则晶胞体积为:4×$\frac{56}{{N}_{A}}$g÷a g•cm-3=$\frac{224}{a{N}_{A}}$cm3,
故答案为:$\frac{224}{a{N}_{A}}$cm3.
点评 本题是对物质结构的考查,涉及元素周期律、核外电子排布、无机物推断、晶胞计算等,是对学生综合能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2S>HCl>HBr>HI | B. | 熔点:Na2O>MgO>CaO | ||
| C. | 微粒半径:F-<Na+<Mg2+ | D. | 还原性:H2S>HCl>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2S | D. | NH3 H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯乙烯使溴水褪色;加成反应 | |
| B. | 乙烯水化生成乙醇;取代反应 | |
| C. | 乙醇与CuO加热反应生成乙醛;氧化反应 | |
| D. | 无水乙醇与浓硫酸加热到170℃制取乙烯;消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 | B. | 0.8 | C. | 0.6 | D. | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{KMnO_{4}(H)}{→}$
$\stackrel{KMnO_{4}(H)}{→}$
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$  (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化) .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com