
| A. | 由于相对分子质量:HCl>HF,故沸点:HCl>HF | |
| B. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| C. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
分析 A.HF分子之间存在氢键,沸点高于HCl;
B.可以存在离子化合物NH4H;
C.处于金属与非金属交界处的元素表现一定的金属性、非金属性;
D.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
解答 解:A.HF分子之间存在氢键,沸点高于HCl,故A错误;
B.可以存在离子化合物NH4H,化学式为NH5,故B错误;
C.Si处于金属与非金属交界处,表现一定的金属性、非金属性,可用作半导体材料,故C正确;
D.电子层结构相同,核电荷数越大离子半径越小,故离子半径:S2->Cl->K+>Ca2+,故D错误,
故选C.
点评 本题考查熔沸点比较、元素周期表、微粒半径比较等,难度不大,注意理解掌握微粒半径比较.


科目:高中化学 来源: 题型:选择题
| A. |  向氯化铝溶液中加入过量的氨水 | |
| B. | 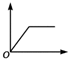 向饱和石灰水中通入过量的CO2气体 | |
| C. |  向MgCl2、AlCl3的混合液中逐滴加入NaOH溶液至过量 | |
| D. | 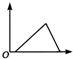 向含少量NaOH的偏铝酸钠溶液中通入过量的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
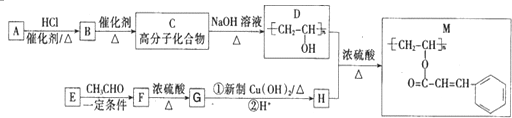
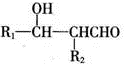
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Fe2+、NO3-、HCO3- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | K+、AlO2-、Cl-、SO42- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.6 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Ba(OH)2溶液中,c(Ba2+)=2c(OH-) | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 在难溶电解质的饱和溶液中,电解质的Ksp越小,其物质的量浓度越小 | |
| D. | 反应5S2O82-+2Mn2++8H20═10SO42-+2MnO4-+16H+,得电子的元素是氧元素,反应中转移10e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
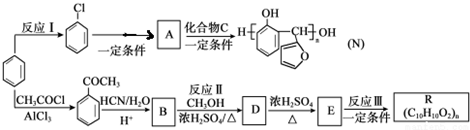
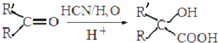
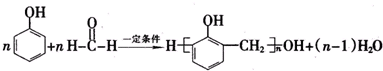
 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•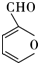
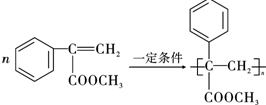
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸与酸性高锰酸钾溶液反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸,敞口放置:2H++2I-+O2═I2+2H2O | |
| D. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com