
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)根据方程式知,二氧化氮是生成物,在达到平衡状态前,二氧化氮浓度增大,开始时c(NO)=$\frac{0.020mol}{2L}$=0.010mol/L,则c是NO变化曲线,二氧化氮和NO的计量数相等,所以其浓度变化相同,达到平衡状态时,△c(NO)=$\frac{0.020-0.007}{2}$mol/L=0.0065mol/L;
先计算NO平均化学反应速率,再根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算氧气平均反应速率;
NO的转化率=$\frac{参加反应的NO的物质的量}{NO的总物质的量}×100%$;
(2)可逆反应达到平衡状态时,正逆反应速率相等,且反应体系中各物质的物质的量、物质的量浓度、百分含量等一系列物理量都不变;
(3)增大反应物浓度、升高温度、增大压强、加入催化剂等方法都能增大反应速率.
解答 解:(1)根据方程式知,二氧化氮是生成物,在达到平衡状态前,二氧化氮浓度增大,开始时c(NO)=$\frac{0.020mol}{2L}$=0.010mol/L,则c是NO变化曲线,二氧化氮和NO的计量数相等,所以其浓度变化相同,达到平衡状态时,△c(NO)=$\frac{0.020-0.007}{2}$mol/L=0.0065mol/L,则二氧化氮变化曲线是b;
v(NO)=$\frac{\frac{0.020-0.008}{2}}{2}$mol/(L.s)=0.003mol/L,同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,则氧气的平均反应速率为1.5×10-3 mol•L-1•s-1,NO的转化率=$\frac{参加反应的NO的物质的量}{NO的总物质的量}×100%$=$\frac{(0.020-0.007)mol}{0.020mol}×100%$=65%,
故答案为:b;1.5×10-3 mol•L-1•s-1;65%;
(2)a.无论是否达到平衡状态,都存在v(NO2)=2v(O2),所以不能据此判断平衡状态,故错误;
b.反应前后气体的物质的量减小,压强降低,当容器内压强保持不变时该反应达到平衡状态,故正确;
c.v逆(NO)=2v正(O2)=v正(NO)时,正逆反应速率相等,反应达到平衡状态,故正确;
d.无论反应是否达到平衡状态,容器内气体质量和容器体积都不变,则容器内密度始终保持不变,不能据此判断平衡状态,故错误;
故选bc;
(3)增大反应物浓度、升高温度、增大压强、加入催化剂等方法都能增大反应速率,
a.及时分离出NO2气体,压强减小,反应速率降低,故错误;
b.适当升高温度,活化分子百分数增大,反应速率加快,故正确;
c.增大O2的浓度,单位体积内活化分子个数增大,反应速率加快,故正确;
d.充入Ar气,反应物和生成物浓度不变,化学反应速率不变,故错误;
故选bc.
点评 本题考查化学平衡有关计算、化学平衡状态判断、化学反应速率影响因素等知识点,为高频考点,侧重考查学生分析判断、计算及图象分析能力,明确化学基本原理是解本题关键,注意(3)中d选项为易错点.


科目:高中化学 来源: 题型:实验题
| 实验编号 药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅由碳元素组成的物质一定是纯净物 | |
| B. | C60是碳的一种同素异形体 | |
| C. | C60的摩尔质量是720g | |
| D. | 石墨转变为金刚石不属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应在不加热的条件下一定不能发生 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 由“100KPa时石墨转化为金刚石,要吸收1.895kJ的热能”可知在100KPa压强下石墨比金刚石稳定 | |
| D. | 化学反应中的能量变化,只表现为热能的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 元素周期表有7个主族、7个副族、1个0族、1个Ⅷ族,共18个纵行 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml~120ml | B. | 100ml~120ml | C. | 110ml~130ml | D. | 100ml~130ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 混合物 | 方程式 |
| ① | 溶液:FeCl2 (FeCl3) | |
| ② | 固体:SiO2 (CaCO3) | |
| ③ | 气体:CO2 (HCl) | |
| ④ | 固体:NaCl(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
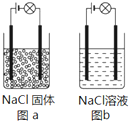 某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )
某化学兴趣小组在家中进行化学实验,按照图a连接好线路发现灯泡不亮,按照图b连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在在电流作用下电离成Na+和Cl- | |
| D. | NaCl溶液中存在大量可自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com