
| A. | 乙烯使溴的四氯化碳溶液褪色 | B. | 由乙酸制乙酸乙酯 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 甲烷与氯气在光照条件下发生反应 |
科目:高中化学 来源: 题型:解答题

| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2 溶液 | 0.1gMnO2粉末 |
| ④ | 10mL 5% H2O2 溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10mL 5% H2O2 溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 每有1 mol Cu参加反应时转移2 mol e- | |
| C. | 氧化产物只有CuSO4 | |
| D. | 浓硫酸既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
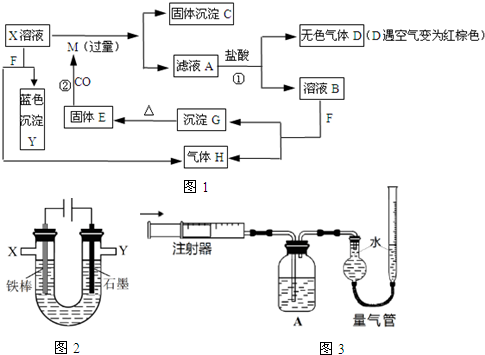
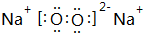 ;G的化学式为Fe(OH)3.
;G的化学式为Fe(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱反应 | B. | 强酸与强碱反应 | ||
| C. | 一元强酸和一元碱反应 | D. | 强酸与强碱反应生成水和可溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据一次能源和二次能源的划分,氢气为二次能源 | |
| B. | 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 | |
| C. | 火电是将燃料中的化学能直接转化为电能的过程 | |
| D. | 原电池工作过程中是直接将化学能转化为电能的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com