
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
| ①中实验 | ②中现象 | |
| A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| B | 加热NH4Cl和Ca(OH)2 的混合物 | 酚酞溶液变红 |
| C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
| D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
科目:高中化学 来源: 题型:
现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
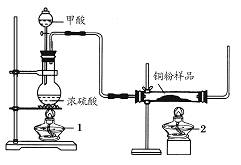
(1)制备一氧化碳的化学方程式是___________________。
(2)实验中,观察到反应管中发生的现象是_____________;尾气的主要成分是_________。
(3)反应完成后,正确的操作顺序为________(填字母)
a.关闭漏斗开关 b.熄灭酒精灯1 c.熄灭酒精灯2
(4)若实验中称取铜粉样品10.0 g,充分反应后,反应管中剩余固体的质量为9.6 g,则原样品中单质铜的质量分数为________。
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的最佳方案:
①设计方案的主要步骤是(不必描述操作过程的细节)__________;
②写出有关反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
BF3熔点和沸点都比较低,下列有关叙述不正确的是
A.BF3分子中键与键之间的夹角为120° B.BF3中心原子采用sp3杂化
C.BF3分子呈正三角形,中心原子无孤对电子 D.BF3分子立体结构与CO32-相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质应用和组成的说法正确的是( )
A.P2O5可用于干燥Cl2和NH3
B.“可燃冰”主要成分是甲烷和水
C.CCl4可用于鉴别溴水和碘水
D.Si和SiO2都用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
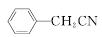 +H2O+H2SO4
+H2O+H2SO4
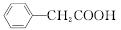 +NH4HSO4
+NH4HSO4
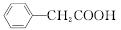 | |||
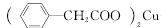 | |||
+Cu(OH)2―→ +H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
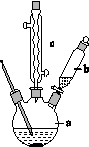
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是______________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是__________;仪器c的名称是__________,其作用是____________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是____________(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是____________,最终得到44 g纯品,则苯乙酸的产率是____________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是__________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
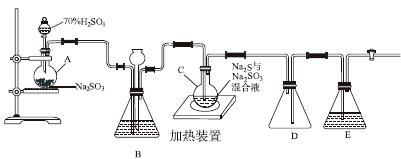
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)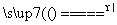 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O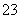 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
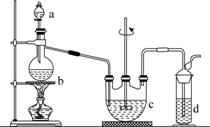
回答下列问题:
(1)b中反应的离子方程式为________________,c中试剂为________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是________。
(3)d中的试剂为________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
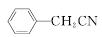 +H2O+H2SO4
+H2O+H2SO4
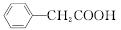 +NH4HSO4
+NH4HSO4
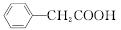 | |||
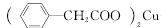 | |||
+Cu(OH)2―→ +H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是______________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是__________;仪器c的名称是__________,其作用是____________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是____________(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是____________,最终得到44 g纯品,则苯乙酸的产率是____________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是__________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石
(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是
可燃性气体,则其反应的化学方程式为 。 该可燃气体在酸性
条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
① 原电池反应:
 负极:2Fe-4e-=2Fe2+、正极: ;
负极:2Fe-4e-=2Fe2+、正极: ;
② 氢氧化物的形成: Fe2 + + 2OH-= Fe(OH) 2↓ 。
③ 氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。
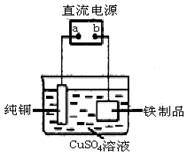
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),
铁制品表面发生的电极反应式 为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com