
| A、碳酸钠 | B、氢氧化钠 |
| C、碳酸氢钠 | D、氯化铵 |
| ||


科目:高中化学 来源: 题型:
| A、在同温同压时,相同体积的任何气体所含的原子数目相同 |
| B、将49gH2SO4溶于1L水中,所得溶液的物质的量浓度为0.5mol?L-1 |
| C、标准状况下,11.2L水所含的分子数为0.5NA |
| D、18g NH4+含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| 试剂A |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
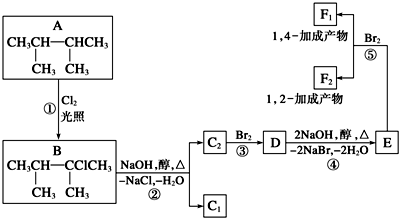
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有大量Cl- |
| B、加入硝酸后的溶液中,滴加BaCl2溶液,有白色沉淀生成,证明原溶液中一定有大量SO42- |
| C、加入盐酸后,放出能使澄清石灰水变浑浊的无色气体,证明原溶液中一定含有大量CO32- |
| D、加入无色酚酞试液后,溶液显红色,证明原溶液中一定含有大量OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
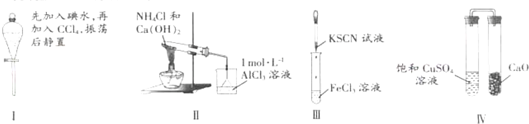
| A、实验Ⅰ:液体分层,下层呈无色 |
| B、实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C、实验Ⅲ:试管中溶液颜色仍无色 |
| D、实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C CuO FeO |
| B、(NH4)2SO4 K2SO4 NH4Cl |
| C、Na2CO3 NaHCO3 K2CO3 |
| D、AgNO3 KNO3 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com