




 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:不详 题型:单选题
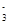 与R-可发生反应:RO
与R-可发生反应:RO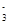 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )| A.元素R位于周期表中第ⅤA族 |
B.RO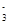 中的R只能被还原 中的R只能被还原 |
C.若1mol RO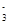 参与该反应,则转移的电子的物质的量为5mol 参与该反应,则转移的电子的物质的量为5mol |
| D.R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9.0L | B.13.5L | C.15.7L | D.16.8L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+2a | B.+a | C.+a/2 | D.+a/4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cr2O72-+ H2O
Cr2O72-+ H2O| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com