
化学活动课上,三组学生分别用图示甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
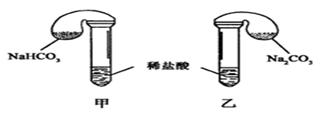
请回答:
(1) 各组反应开始时, 装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 组 数 | 试剂用量 | 实验现象 (气球体积变化) | 分析原因 |
| ① | 0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
| ② | 0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| ③ | 0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
(1) 甲 HCO3-+H+=CO2 ↑+H2O (2) ②甲、乙盐酸均过量 n(NaHCO3) >n(Na2CO3) V甲(CO2)> V乙 (CO2) ③ 甲、乙盐酸均不足量 消耗的n(NaHCO3) >n(Na2CO3) V甲(CO2) > V乙(CO2);CO2+ CO32-+H2O=2HCO3-
(1)根据化学方程式计算可知第①组中NaHCO3和Na2CO3都已完全反应。对比第①组数据知第②组中盐酸一定过量,NaHCO3和Na2CO3一定完全反应,且NaHCO3产生的CO2比Na2CO3的多。第③组中,n(Na2CO3)=0.0057mol,n(NaHCO3)=0.0071mol,n(HCl)=0.006mol。把Na2CO3缓慢加入到盐酸中,在盐酸反应完以前,盐酸是过量的而Na2CO3是少量的。因此开始发生的反应是:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据化学方程式,有:Na2CO3 + 2HCl == 2NaCl + CO2↑+H2O
0.003mol 0.006mol 0.003mol
NaHCO3 + HCl == NaCl + CO2↑+H2O
0.006mol 0.006mol 0.006mol
说明Na2CO3、NaHCO3都过量,NaHCO3产生的CO2较Na2CO3的多。因为气体收集于气球中,乙中CO2又与过量的Na2CO3溶液反应。


科目:高中化学 来源: 题型:
化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3,和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。

请回答:
(1)各组反应开始时_____________,装置中的气球体积先变大,该装置中反应的离子方程式是_________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 | 分析原因 | |
| 第①组 | 0.42 g NaHCO3 0.53 g Na2CO3 3 mL 4 mol / L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)= V乙(CO2) |
| 第②组 | 0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol / L盐酸 | 甲中气球比乙中气球的体积大 | |
| 第③组 | 0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol / L盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学活动课上,三组学生分别用图示甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
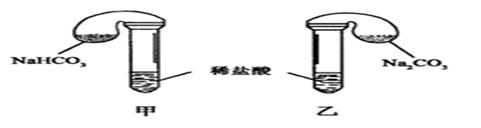
请回答:
(1) 各组反应开始时, 装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 组 数 | 试剂用量 | 实验现象 (气球体积变化) | 分析原因 |
| ① | 0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
| ② | 0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| ③ | 0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学必修1 3.1碳的多样性练习卷(解析版) 题型:实验题
化学活动课上,三组学生分别用图示甲、乙两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
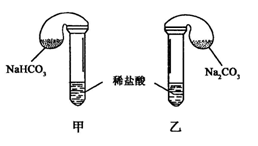
请回答:
(1) 各组反应开始时, 装置中的气球体积先变大,该装置中反应的离子方程式是______。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
|
组 数 |
试剂用量 |
实验现象 (气球体积变化) |
分析原因 |
|
① |
0.42 g NaHCO3;0.53g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球与乙中气球的体积相等 |
甲、乙盐酸均过量,n(NaHCO3)=n(Na2CO3),ν甲(CO2)=ν乙(CO2) |
|
② |
0.3 g NaHCO3;0.3 g Na2CO3;3mL4 mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
|
③ |
0.6 g NaHCO3;0.6 g Na2CO3;3mL 2mol·L-1盐酸 |
甲中气球比乙中气球的体积大 |
|
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变 |
(用离子方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
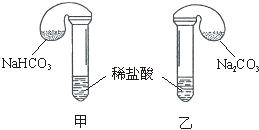
请回答:
(1)各组反应开始时,________装置中的气球体积先变大,该装置中反应的离子方程式是___________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 |
第 ① 组 | 0.42 g NaHCO3 0.53 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)=V乙(CO2) |
第 ② 组 | 0.3 g NaHCO3 0.3 g Na2CO3 3 mL 4 mol/L盐酸 | 甲中气球比乙中气球的体积大 |
|
第 ③ 组 | 0.6 g NaHCO3 0.6 g Na2CO3 3 mL 2 mol/L盐酸 | 甲中气球比乙中气球的体积大 |
|
片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com