
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
分析 A.根据反应Ⅰ、Ⅱ判断;
B.没有告诉在标准状况下,无法计算生成气体体积;
C.反应Ⅱ中氧气为氧化剂、氯气为氧化产物;
D.该反应为气体体积缩小的反应,根据△G=△H-T•△S<0能自发进行判断.
解答 解:A.根据反应Ⅰ、Ⅱ可知,该工艺中MgO可循环利用,故A正确;
B.根据反应可知理论上 1mol NH4Cl制得0.5molCl2,不是标况下生成氯气的体积不一定为11.2L,故B错误;
C.反应2MgCl2+O2$\frac{\underline{\;800~1000℃\;}}{\;}$2MgO+2Cl2中,O2为氧化剂、Cl2为氧化产物,应该是O2的氧化性强于Cl2的氧化性,故C错误;
D.反应反应2NH3+MgCl2+H2O═2NH4Cl+MgO为气体体积缩小的反应,其△S<0,该反应能自发进行,则△G=△H-T•△S<0,则△H<0,故D错误;
故选A.
点评 本题考查了反应热与焓变的应用,题目难度中等,涉及氧化还原反应、反应自发进行的判断、物质的量计算等知识,明确化学反应与能量变化的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:解答题
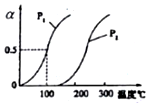 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者的分子个数之比为16:17 | |
| B. | 二者的原子个数之比为17:16 | |
| C. | 二者的氢原子个数之比为17:12 | |
| D. | 同温同压下两种气体的体积之比为16:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 和4He是同一种原子 | B. | 比4He少一个质子 | ||
| C. | 是4He的同位素 | D. | 比4He多一个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
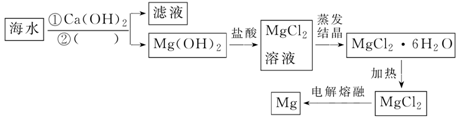
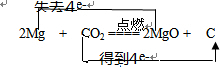 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
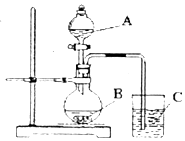 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
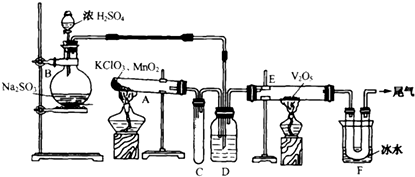
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com