下列说法正确的是( )
A.中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3
B.已知难溶物FeS的Ksp=8.1×10-17,FeS饱和溶液中c(H+)2?c(S2-)=1.0×10-22,为使溶液里c(Fe2+)达到了1mol?L-1,应调节溶液中的c(H+)为1.11×10-3mol?L-1
C.稀氨水中部分粒子的浓度大小关系:c(NH4+)>c(OH-)>c(H+)>c
D.已知氢气的标准燃烧热为285.8kJ?mol-1,相应的热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-285.8kJ?mol-1
【答案】
分析:A.H
+的浓度相同,则消耗的碱相同,醋酸为弱酸,则醋酸消耗的碱最多;
B.根据饱和溶液中c(H
+)
2?c(S
2-)=1.0×10
-22来分析;
C.氨水中NH
3?H
2O电离,且电离程度不大;
D.燃烧热是指1mol可燃物生成稳定氧化物放出的热量,气态水不是稳定氧化物.
解答:解:A.相同pH的①硫酸、②盐酸,H
+的浓度相同,则消耗的碱相同,而醋酸为弱酸,pH相同时,其浓度最大,消耗的碱最多,所需相同浓度的NaOH溶液的体积关系为V
1=V
2<V
3,故A错误;
B.FeS的K
sp=8.1×10
-17,FeS饱和溶液中c(H
+)
2?c(S
2-)=1.0×10
-22,为使溶液里c(Fe
2+)达到了1mol?L
-1,c(S
2-)=
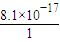
=8.1×10
-17,c(H
+)=
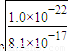
=1.11×10
-3mol?L
-1,故B正确;
C.氨水中NH
3?H
2O电离,且电离程度不大,则稀氨水中部分粒子的浓度大小关系为c(NH
3?H
2O)>c(OH
-)>c(NH
4+)>c(H
+),故C错误;
D.已知氢气的标准燃烧热为285.8kJ?mol
-1,相应的热化学方程式为H
2(g)+

O
2(g)=H
2O(l)△H=-285.8kJ?mol
-1,故D错误;
故选B.
点评:本题为小综合,考查知识点较多,注重pH的计算、溶度积的计算、离子浓度大小的比较、热化学反应方程式,题目难度较大,为高考中的常考考点.

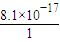 =8.1×10-17,c(H+)=
=8.1×10-17,c(H+)=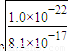 =1.11×10-3mol?L-1,故B正确;
=1.11×10-3mol?L-1,故B正确; O2(g)=H2O(l)△H=-285.8kJ?mol-1,故D错误;
O2(g)=H2O(l)△H=-285.8kJ?mol-1,故D错误;

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,