
【题目】一瓶不纯的K2CO3粉末,所含杂质可能是KNO3、Ca(NO3)2、KCl、CuCl2、Na2SO4中的一种或几种。为确定其成分,进行如下实验:
(1)取少量该粉末于烧杯中,加入适量蒸馏水,充分搅拌,得无色澄清溶液。
(2)在上述无色溶液中加入足量的BaCl2溶液,有白色沉淀生成,过滤,得无色溶液。
(3)取少许(2)中过滤后的无色溶液于试管中,滴加AgNO3溶液有白色沉淀生成。
下列说法正确的是( )
A.杂质中可能含有KNO3、CuCl2
B.杂质中肯定不含有Ca(NO3)2、CuCl2
C.杂质中肯定含有KCl、Na2SO4
D.杂质中肯定含有KCl,可能含有KNO3、Na2SO4
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】维生素C的结构简式是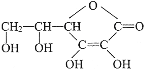 ,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:
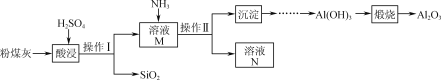
(1)操作Ⅰ的名称是________;溶液N中的溶质主要是____________(填化学式)。
(2)用H2SO4“酸浸”时的离子方程式为__________________________________(任写一个)。
(3)“煅烧”时的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体(MgSO4·7H2O)的流程如图:
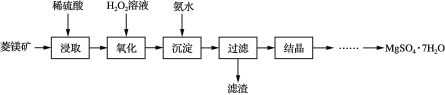
(1)“浸取”时通常将菱镁矿石进行粉碎,其目的是___。
(2)写出碳酸镁与稀硫酸反应的化学方程式___。
(3)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则“过滤”所得滤液中含有的阳离子主要有___和___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃C5H12有三种同分异构体,有关它们的结构和性质的说法不正确的是( )
A.三种同分异构体在常温常压下均为液体
B.其中一种同分异构体的碳原子间结构:具有空间正四面体对称结构
C.三种同分异构体具有相同的分子式.相对原子质量,化学性质相似
D.C5H11Cl共有8种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学的核心是发生化学反应,利用化学反应合成物质,同时也伴随有能量的变化,下列有关说法中不正确的是( )
A.只要发生化学反应就一定有能量变化
B.Zn+2HCl=ZnCl2+H2↑这是一个放热反应,结论:1molZn和2molHCl的能量之和高于1molZnCl2和1molH2的能量之和
C.反应A+B=C+D的能量变化如图所示,反应物A和B断裂化学键吸收总能量低于形成生成物C和D释放的总能量

D.发生化学反应实现了化学能和其他形式能量之间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态原子由原子核和绕核运动的电子组成,下列有关核外电子说法正确的是
A.基态原子的核外电子填充的能层数与元素所在的周期数相等
B.基态原子的核外电子填充的轨道总数一定大于或等于![]() (m表示原子核外电子数)
(m表示原子核外电子数)
C.基态原子的核外电子填充的能级总数为![]() (n为原子的电子层数)
(n为原子的电子层数)
D.基态原子的核外电子运动都有顺时针和逆时针两种自旋状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能得出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向浓度均为 |
| 非金属性: |
B. | 向含有酚酞的 | 观察到红色变浅 | 证明 |
C | 室温下,用pH试纸测 |
|
|
D. | 向盛有10滴 | 有黄色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
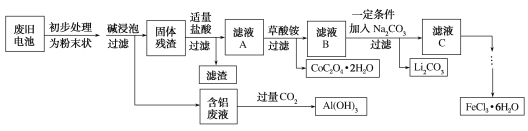
已知:①还原性:Cl->Co2+;
②Fe3+和![]() 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________。
(2)从含铝废液得到Al(OH)3的离子方程式为___________
(3)滤液A中的溶质除HCl、LiCl外还有________(填化学式)。写出LiCoO2和盐酸反应的化学方程式____________
(4)滤渣的主要成分为_______(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
Ⅱ | 300~350 | ______ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com