
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
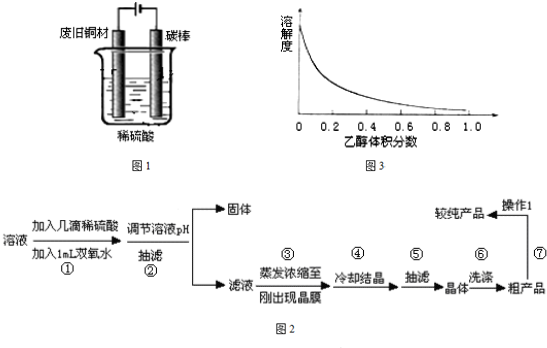
I:制备硫酸铜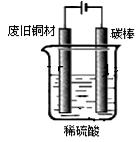
装置如图,写出阳极发生的电极反应式 、 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)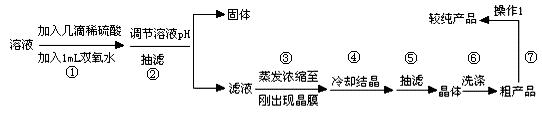
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.5 |
| A.无水乙醇 | B.蒸馏水 |
| C.95%乙醇溶液 | D.饱和硫酸钠溶液 |
科目:高中化学 来源: 题型:
| 离子 | 开始沉淀的pH | 完全沉淀的pH | Fe2+ | 6.4 | 8.4 | Fe3+ | 2.4 | 3.1 | Cu2+ | 5.2 | 6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如图,写出阳极发生的电极反应式 、 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.5 |
(1)写出步骤①发生反应的离子方程式 。
(2)步骤②中可加入 (填化学式)调节溶液pH至 (填范围)。
(3)步骤③不能蒸干的原因是 。
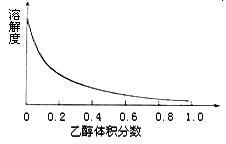
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 。
查看答案和解析>>
科目:高中化学 来源:2012届山东省邹城市高二下学期期末考试化学试卷 题型:填空题
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
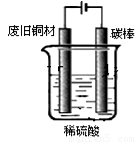
装置如图,写出阳极发生的电极反应式 、 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
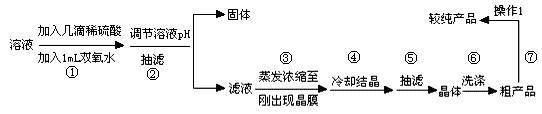
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
|
离子 |
开始沉淀的pH |
完全沉淀的pH |
|
Fe2+ |
6.4 |
8.4 |
|
Fe3+ |
2.4 |
3.1 |
|
Cu2+ |
5.2 |
6.5 |
(1)写出步骤①发生反应的离子方程式 。
(2)步骤②中可加入 (填化学式)调节溶液pH至 (填范围)。
(3)步骤③不能蒸干的原因是 。
(4)下图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 。
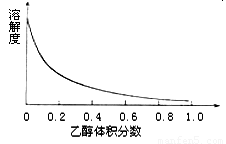
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省台州市高二下学期期末测试化学 题型:选择题
(14分)某研究性学习小组欲利用所学知识制备并提纯硫酸铜。所用原料为废旧铜材(含铁约2%,其它杂质忽略不计),过程如下:
I:制备硫酸铜
装置如右图,写出阳极发生的电极反应式 ▲ 、
▲ 。
II:提纯硫酸铜
待反应结束后,取出电极,按照如下流程提纯得到硫酸铜晶体(CuSO4·5H2O)
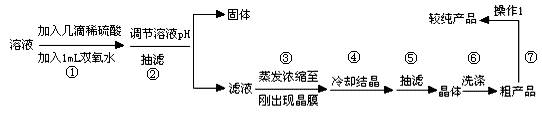
已知此溶液中Fe2+、Fe3+、Cu2+形成氢氧化物的pH如下表
|
离子 |
开始沉淀的pH |
完全沉淀的pH |
|
Fe2+ |
6.4 |
8.4 |
|
Fe3+ |
2.4 |
3.1 |
|
Cu2+ |
5.2 |
6.5 |
(1)写出步骤①发生反应的离子方程式 ▲ 。
(2)步骤②中可加入 ▲ (填化学式)调节溶液pH至 ▲ (填范围)。
(3)步骤③不能蒸干的原因是 ▲ 。
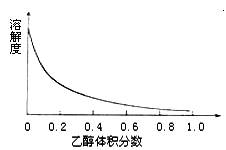
(4)右图表示硫酸铜晶体在乙醇水混合溶剂中溶解度随乙醇体积分数的变化曲线,则最适合作为步骤⑥洗涤液是 ▲ 。
A.无水乙醇 B.蒸馏水
C.95%乙醇溶液 D.饱和硫酸钠溶液
(5)操作1的名称是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com