
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )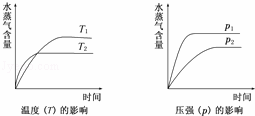
|
| A. | CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0 |
|
| B. | CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0 |
|
| C. | CH3CH2OH(g)⇌CH2=CH2(g)+H2O(g);△H>0 |
|
| D. | 2C6H5CH2CH3(g)+O2(g)⇌2C6H5CH═CH2(g)+2H2O(g);△H<0 |
| 反应热和焓变. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | 由图象可以看出,随着温度的升高,水蒸气的含量减小,说明升高温度平衡向逆反应方向移动,则正反应应为放热反应,增大压强,水蒸气的含量增大,说明增大压强平衡向正反应方向移动,则气体反应物的化学计量数之和大于气体生成物的化学计量数之和,以此解答该题. |
| 解答: | 解:温度越高,反应越快,到达平衡的时间就越少,因此t2>t1;同理压强越大,反应越快,到达平衡的时间就越少,因此p1>p2; A.反应是一个体积不变的、吸热的可逆反应,压强对水蒸气的含量不影响;升高温度平衡向正反应方向移动,增大水蒸气的含量,因此均不符合,故A错误; B.反应是一个体积减小的、放热的可逆反应,因此升高温度平衡向逆反应方向移动,降低水蒸气的含量;而增大压强平衡向正反应方向移动,增大水蒸气的含量,故B正确; C.反应是一个体积增大的、吸热的可逆反应,升高温度平衡向正反应方向移动,增大水蒸气的含量,不符合图象,故C错误; D.反应是一个体积增大的、放热的可逆反应,压强不符合,故D错误. 故选:B. |
| 点评: | 本题考查外界条件对化学平衡的影响及有关图象的分析和识别,题目难度中等,解答本题的关键是能正确分析温度、压强对平衡移动的影响. |


科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 澄清石灰水与盐酸混合Ca(OH)2+2H+=Ca2++2H2O
B. 氢氧化铁与盐酸反应H++OH﹣=H2O
C. 氯化钡溶液与稀硫酸混合Ba2++SO42﹣=BaSO4↓
D. 铝与硝酸汞溶液反应Al+Hg2+=Al3++Hg
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、Na2S、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)中学教材中图示了NaCl晶体,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近的O2-核间距离为a×10-8cm,计算NiO晶体的密度。(已知NiO的摩尔质量为74.7 g·mol-1)

(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物Ni和O的比值却发生了变化。某氧化镍样品的组成为Ni0.97O,试计算晶体中Ni3+与Ni2+的离子个数之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属的冶炼,叙述错误的是( )
|
| A. | 活泼金属钠用电解法冶炼 | B. | 用火法或湿法均可制备铜 |
|
| C. | 金属镁只能用热还原法制备 | D. | 铁的冶炼可以用铝热法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )
|
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
|
| B. | 合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施 |
|
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
|
| D. | 对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
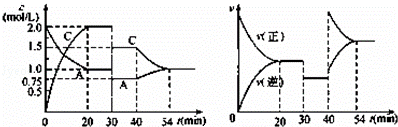
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如图所示.下列说法中正确是( )
|
| A. | 30 min~40 min间该反应使用了催化剂 |
|
| B. | 反应方程式中的x=1,正反应为吸热反应 |
|
| C. | 30~40min改变的条件是将容器的体积扩大至原来的2倍 |
|
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K1=K2>K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
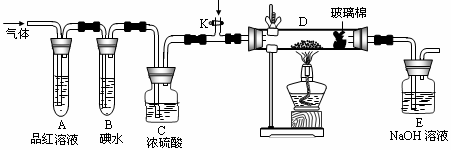
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒,当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙 E.双氧水 F.硝酸银
查看答案和解析>>
科目:高中化学 来源: 题型:
欲使0.1mol·L-1的NaHCO3溶液中c(H+)、c(CO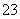 )、c(HCO
)、c(HCO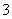 )都减少,其方法是( )
)都减少,其方法是( )
A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com