
 CO2(g) + H2(g)�õ������������ݣ�
CO2(g) + H2(g)�õ������������ݣ�| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
 pC(g) ,��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±�
pC(g) ,��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±�| ѹǿp/Pa | 2��105 | 5��105 | 1��106 |
| c(A)/mol��L-1 | 0.08 | 0.20 | 0.44 |
 .
. 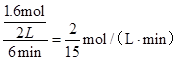 ������֮�ȵ��ڻ�ѧ������֮�ȣ���v��CO2��=v��CO��=
������֮�ȵ��ڻ�ѧ������֮�ȣ���v��CO2��=v��CO��= mol/��L��min��=0.13mol/��L��min����
mol/��L��min��=0.13mol/��L��min���� CO2��g��+H2��g����
CO2��g��+H2��g���� ��100%=20%
��100%=20%
 .
.  ���𰸣�4��10-11
���𰸣�4��10-11

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1:2 | B��2:1 | C��1:3 | D��3:1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��������10mol/L����Һ����ȣ��������������к�ɫ�������� �ڲ����̼�����ζ������ ����Һ������ɫ���ݴ��ж�����˵����ȷ����
��������10mol/L����Һ����ȣ��������������к�ɫ�������� �ڲ����̼�����ζ������ ����Һ������ɫ���ݴ��ж�����˵����ȷ����| A����Ӧ�������������� | B�� ����Ԫ�ر����� ����Ԫ�ر����� |
| C���̼�����ζ�������ǰ��� | D��1mol ��ȫ��Ӧת��0��5mol���� ��ȫ��Ӧת��0��5mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ñ�״����4.48LCH4��ԭNO2����N2��ˮ�������ų�����Ϊ173.4 kJ/mol |
| B���ɷ�Ӧ�ٿ���֪CH4(g)+4NO2��g��=4NO(g)+CO2��g��+2H2O(l)��H��-574kJ/mol |
| C����Ӧ���е�4.48LCH4��Ӧ��ȫʱת�Ƶĵ�������Ϊ1.60mol |
| D����Ӧ�٢�ת�Ƶĵ�������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��5 | B��4 | C��3 | D��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��0~b ��3HSO3��+ IO3���� 3SO4����+ I��+ 3H�� |
| B��a��ʱ����NaHSO3�����ʵ���Ϊ1��2 mol |
| C��b~c��I2�ǻ�ԭ���� |
| D������Һ��I¯��I2�����ʵ���֮��Ϊ5��2ʱ�������KIO3Ϊ1��8mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HCOOH+O2������˵����ȷ����
2HCOOH+O2������˵����ȷ����| A��HCOOH�����к��м��Լ������зǼ��Լ� |
| B����Ӧ�У�CO2��������O2�ǻ�ԭ���� |
| C����Ӧ�У�ÿת��4��6.02��1022�����ӣ�����2.24L���� |
| D���ù����ǽ�̫����ת��Ϊ��ѧ�ܵĹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��M | B��M2+ | C��M3+ | D��MO2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1��7 | B��1��5 | C��1��9 | D��2��9 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com