
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
科目:高中化学 来源:不详 题型:单选题
| A.原子半径比阴离子半径小 |
| B.原子半径比阴离子半径大 |
| C.原子半径比阳离子半径小 |
| D.带正电荷多的阳离子比带正电荷少的阳离子半径大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素 | R | W | X | Y | Z |
| 化合价 | –4 | +1 | –4 | –2 | –1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1s22s22p63s23p63d54s1 |
| B.1s22s22p63s23p3 |
| C.1s22s22p63s23p63d64s2 |
| D.1s22s22p63s23p63d74s2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X2YZ4 | B.XYZ3 | C.X3YZ4 | D.X4Y2Z7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.①②③ | B.②④⑤ | C.②③④ | D.①②④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
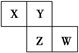
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性W比Z弱 |
| C.Y的气态氢化物的稳定性较Z的弱 |
| D.四种元素的单质中,Z的熔、沸点最高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)  H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)  H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。 H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的 H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com