
【题目】下列有关实验现象、解释和结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热 | 无砖红色沉淀 | 淀粉水解产物不含醛基 |
C | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 mol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
【答案】A
【解析】
A.红棕色变深,说明升高温度,平衡移动,二氧化氮的浓度增大;B、用新制Cu(OH)2浊液检验淀粉的水解产物葡萄糖的存在时,必须保证溶液呈碱性;C.滴加稀氢氧化钠溶液,加热,试纸不变蓝,说明原溶液中无铵根离子;D、AgNO3是过量的,再加NaI,不能确定是AgCl转化为AgI。
A.红棕色变深,说明升高温度,平衡移动,二氧化氮的浓度增大,则说明反应2NO2![]() N2O4的△H<0,选项A正确;B、用新制Cu(OH)2浊液检验淀粉的水解产物葡萄糖的存在时,必须保证溶液呈碱性,而淀粉溶液水解时加入稀H2SO4做催化剂,故想检验葡萄糖的生成,须在水解液中加过量的碱使溶液呈碱性,冷却后再加入新制Cu(OH)2浊液,若有砖红色沉淀生成,说明水解产物为葡萄糖,选项B错误;C、氨气极易溶于水,若溶液中含有少量的NH4+时,滴加稀NaOH溶液不会放出NH3,选项C错误;D、1mL溶液约有20滴,向1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,AgNO3是过量的,再加NaI,不能确定是AgCl转化为AgI,所以不能比较Ksp,故D错误。答案选A。
N2O4的△H<0,选项A正确;B、用新制Cu(OH)2浊液检验淀粉的水解产物葡萄糖的存在时,必须保证溶液呈碱性,而淀粉溶液水解时加入稀H2SO4做催化剂,故想检验葡萄糖的生成,须在水解液中加过量的碱使溶液呈碱性,冷却后再加入新制Cu(OH)2浊液,若有砖红色沉淀生成,说明水解产物为葡萄糖,选项B错误;C、氨气极易溶于水,若溶液中含有少量的NH4+时,滴加稀NaOH溶液不会放出NH3,选项C错误;D、1mL溶液约有20滴,向1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,AgNO3是过量的,再加NaI,不能确定是AgCl转化为AgI,所以不能比较Ksp,故D错误。答案选A。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下列三种有机物是某些药物中的有效成分
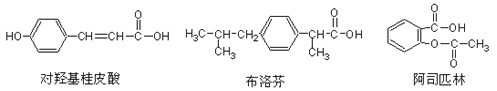
下列说法正确的是( )
A. 三种有机物都能发生水解反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
D. 使用FeCl3溶液和稀硫酸可以鉴别这三种有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料氧缺位铁酸盐(MFe2Ox)(32、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述不正确的是
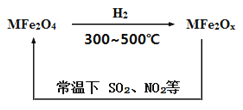
A. MFe2O4表现了氧化性
B. 若MFe2Ox与SO2发生反应的物质的量之比为3:1,则x=10/3
C. 在处理该废气过程中,每处理含1moINO2的废气转移电子数4NA个
D. MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸、碱、盐的说法中正确的是( )
A.酸根中不可能含有氧元素B.能与碱发生反应生成水的化合物是酸
C.电离时有金属阳离子产生的化合物一定是盐D.酸不可能电离产生金属阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物 质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙 醇 | -114 | 78.4 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓H2SO4 | 338 | 1.84 |



实验室制取乙酸乙酯的主要装置如上图I所示,主要步骤为:①在30mL的大试管中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合液;②按照图I连接装置,使产生的蒸气经导管通到盛有10mL饱和Na2CO3溶液的(加入2滴酚酞试液)试管中;③小火加热试管中的混合液;④待小试管中收集约2mL产物时停止加热,撤出小试管并用力振荡,然后静置;⑤分离出纯净的乙酸乙酯。请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_____________________________;
(2)写出该实验制取乙酸乙酯的化学方程式_________________________________,浓H2SO4的作用是 _______________________;
(3)步骤③中,用小火加热试管中的混合液,其原因_________________________;
(4)步骤④所观察到的现象是___________________________________________________
(5)步骤⑤中,分离出乙酸乙酯的方法是_________________________________;
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取圆底烧瓶中产物)。你认为哪种装置更合理,为什么?_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
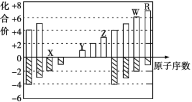
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有氧化铜和氧化亚铜两种氧化物,关于它们的比较说法中不正确的是( )
A.氧化铜为黑色,氧化亚铜为红色B.铜元素的化合价不相同
C.都能溶于水生成氢氧化铜蓝色沉淀D.都能被氢气还原为单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 和SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法来减少这些有害气体的排放。
I.H2S 的除去
方法1: 生物脱H2S,反应的原理为H2S + Fe2(SO4)3==S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O。
2Fe2(SO4)3 +2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105 倍,该菌的作用是______。
(2)由图1和图2 判断,使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是______________。


方法2: 在一定条件下,用H2O2 氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S) 变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物 的分子式为________。
II.SO2 的除去
方法1( 双碱法): 用NaOH 吸收SO2 ,并用CaO 使NaOH 再生:NaOH 溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:_________________。
(5)CaO 在水中存在如下转化:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
方法2:用氨水除去SO2
(6)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol/L,溶液中的c(OH-)=________。将SO2 通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c (SO32-)/c(HSO3-) =_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com